+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | In situ cryo-EM structure of bacteriophage Sf6 portal:gp7 complex at 2.7A resolution | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | in situ / phage / portal / gp7 / gp3 / structural protein / VIRAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Shigella phage Sf6 (ファージ) / Shigella phage Sf6 (ファージ) /  Shigella virus Sf6 (ウイルス) Shigella virus Sf6 (ウイルス) | |||||||||
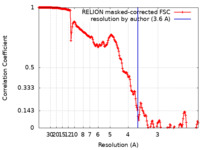
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Li F / Cingolani G / Hou C | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2022 ジャーナル: Sci Adv / 年: 2022タイトル: High-resolution cryo-EM structure of the virus Sf6 genome delivery tail machine. 著者: Fenglin Li / Chun-Feng David Hou / Ruoyu Yang / Richard Whitehead / Carolyn M Teschke / Gino Cingolani /  要旨: Sf6 is a bacterial virus that infects the human pathogen Here, we describe the cryo-electron microscopy structure of the Sf6 tail machine before DNA ejection, which we determined at a 2.7-angstrom ...Sf6 is a bacterial virus that infects the human pathogen Here, we describe the cryo-electron microscopy structure of the Sf6 tail machine before DNA ejection, which we determined at a 2.7-angstrom resolution. We built de novo structures of all tail components and resolved four symmetry-mismatched interfaces. Unexpectedly, we found that the tail exists in two conformations, rotated by ~6° with respect to the capsid. The two tail conformers are identical in structure but differ solely in how the portal and head-to-tail adaptor carboxyl termini bond with the capsid at the fivefold vertex, similar to a diamond held over a five-pronged ring in two nonidentical states. Thus, in the mature Sf6 tail, the portal structure does not morph locally to accommodate the symmetry mismatch but exists in two energetic minima rotated by a discrete angle. We propose that the design principles of the Sf6 tail are conserved across P22-like Podoviridae. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_26582.map.gz emd_26582.map.gz | 395.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-26582-v30.xml emd-26582-v30.xml emd-26582.xml emd-26582.xml | 10.2 KB 10.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_26582_fsc.xml emd_26582_fsc.xml | 18.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_26582.png emd_26582.png | 82 KB | ||
| Filedesc metadata |  emd-26582.cif.gz emd-26582.cif.gz | 5.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-26582 http://ftp.pdbj.org/pub/emdb/structures/EMD-26582 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26582 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26582 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_26582_validation.pdf.gz emd_26582_validation.pdf.gz | 589.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_26582_full_validation.pdf.gz emd_26582_full_validation.pdf.gz | 589.3 KB | 表示 | |
| XML形式データ |  emd_26582_validation.xml.gz emd_26582_validation.xml.gz | 16.1 KB | 表示 | |
| CIF形式データ |  emd_26582_validation.cif.gz emd_26582_validation.cif.gz | 22.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26582 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26582 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26582 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26582 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_26582.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_26582.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.122 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Shigella virus Sf6
| 全体 | 名称:  Shigella virus Sf6 (ウイルス) Shigella virus Sf6 (ウイルス) |
|---|---|
| 要素 |
|
-超分子 #1: Shigella virus Sf6
| 超分子 | 名称: Shigella virus Sf6 / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 10761 / 生物種: Shigella virus Sf6 / ウイルスタイプ: VIRION / ウイルス・単離状態: OTHER / ウイルス・エンベロープ: Yes / ウイルス・中空状態: Yes |
|---|
-分子 #1: Gene 14 protein
| 分子 | 名称: Gene 14 protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Shigella phage Sf6 (ファージ) Shigella phage Sf6 (ファージ) |
| 分子量 | 理論値: 67.118141 KDa |
| 配列 | 文字列: MTDIITNVVI GMPSQLFTMA RSFKAVANGK IYIGKIDTDP VNPENQIQVY VENEDGSHVP VSQPIVINAA GYPVYNGQIA KFVTEQGHS MAVYDAYGSQ QFYFQNVLKY DPDQFGPDLI EQLAQSGKYS QDNTKGDAMI GVKQPLPKAV LRTQHDKNKE A ISILDFGV ...文字列: MTDIITNVVI GMPSQLFTMA RSFKAVANGK IYIGKIDTDP VNPENQIQVY VENEDGSHVP VSQPIVINAA GYPVYNGQIA KFVTEQGHS MAVYDAYGSQ QFYFQNVLKY DPDQFGPDLI EQLAQSGKYS QDNTKGDAMI GVKQPLPKAV LRTQHDKNKE A ISILDFGV IDDGVTDNYQ AIQNAIDAVA SLPSGGELFI PASNQAVGYI VGSTLLIPGG VNIRGVGKAS QLRAKSGLTG SV LRLSYDS DTIGRYLRNI RVTGNNTCNG IDTNITAEDS VIRQVYGWVF DNVMVNEVET AYLMQGLWHS KFIACQAGTC RVG LHFLGQ CVSVSVSSCH FSRGNYSADE SFGIRIQPQT YAWSSEAVRS EAIILDSETM CIGFKNAVYV HDCLDLHMEQ LDLD YCGST GVVIENVNGG FSFSNSWIAA DADGTEQFTG IYFRTPTSTQ SHKIVSGVHI NTANKNTAAN NQSIAIEQSA IFVFV SGCT LTGDEWAVNI VDINECVSFD KCIFNKPLRY LRSGGVSVTD CYLAGITEVQ KPEGRYNTYR GCSGVPSVNG IINVPV AVG ATSGSAAIPN PGNLTYRVRS LFGDPASSGD KVSVSGVTIN VTRPSPVGVA LPSMVEYLAI UniProtKB: Gene 14 protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 7977 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: OTHER / 撮影モード: OTHER / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 81000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)