+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-25447 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The complex of phosphorylated human cystic fibrosis transmembrane conductance regulator (CFTR) with ATP/Mg and Lumacaftor (VX-809) | |||||||||
 マップデータ マップデータ | E1371QCFTR/lumacaftor/ATP | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ABC transporter / ion channel / folding correction / MEMBRANE PROTEIN / ATP-BINDING PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of voltage-gated chloride channel activity / positive regulation of cyclic nucleotide-gated ion channel activity / Sec61 translocon complex binding / channel-conductance-controlling ATPase / intracellularly ATP-gated chloride channel activity / positive regulation of enamel mineralization / transepithelial water transport / RHO GTPases regulate CFTR trafficking / intracellular pH elevation / amelogenesis ...positive regulation of voltage-gated chloride channel activity / positive regulation of cyclic nucleotide-gated ion channel activity / Sec61 translocon complex binding / channel-conductance-controlling ATPase / intracellularly ATP-gated chloride channel activity / positive regulation of enamel mineralization / transepithelial water transport / RHO GTPases regulate CFTR trafficking / intracellular pH elevation / amelogenesis / ATPase-coupled inorganic anion transmembrane transporter activity / chloride channel inhibitor activity / Golgi-associated vesicle membrane / multicellular organismal-level water homeostasis / membrane hyperpolarization / cholesterol transport / bicarbonate transport / bicarbonate transmembrane transporter activity / vesicle docking involved in exocytosis / chloride channel regulator activity / chloride transmembrane transporter activity / sperm capacitation / chloride channel activity / RHOQ GTPase cycle / cholesterol biosynthetic process / positive regulation of exocytosis / positive regulation of insulin secretion involved in cellular response to glucose stimulus / chloride channel complex / ATPase-coupled transmembrane transporter activity / ABC-type transporter activity / cellular response to cAMP / cellular response to forskolin / chloride transmembrane transport / isomerase activity / response to endoplasmic reticulum stress / establishment of localization in cell / PDZ domain binding / Defective CFTR causes cystic fibrosis / Late endosomal microautophagy / clathrin-coated endocytic vesicle membrane / ABC-family proteins mediated transport / recycling endosome / transmembrane transport / Aggrephagy / Chaperone Mediated Autophagy / recycling endosome membrane / Cargo recognition for clathrin-mediated endocytosis / Clathrin-mediated endocytosis / early endosome membrane / protein-folding chaperone binding / early endosome / endosome membrane / Ub-specific processing proteases / apical plasma membrane / lysosomal membrane / endoplasmic reticulum membrane / enzyme binding / cell surface / ATP hydrolysis activity / protein-containing complex / ATP binding / membrane / nucleus / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
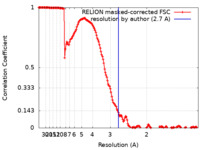
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||
 データ登録者 データ登録者 | Fiedorczuk K / Chen J | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2022 ジャーナル: Cell / 年: 2022タイトル: Mechanism of CFTR correction by type I folding correctors. 著者: Karol Fiedorczuk / Jue Chen /  要旨: Small molecule chaperones have been exploited as therapeutics for the hundreds of diseases caused by protein misfolding. The most successful examples are the CFTR correctors, which transformed cystic ...Small molecule chaperones have been exploited as therapeutics for the hundreds of diseases caused by protein misfolding. The most successful examples are the CFTR correctors, which transformed cystic fibrosis therapy. These molecules revert folding defects of the ΔF508 mutant and are widely used to treat patients. To investigate the molecular mechanism of their action, we determined cryo-electron microscopy structures of CFTR in complex with the FDA-approved correctors lumacaftor or tezacaftor. Both drugs insert into a hydrophobic pocket in the first transmembrane domain (TMD1), linking together four helices that are thermodynamically unstable. Mutating residues at the binding site rendered ΔF508-CFTR insensitive to lumacaftor and tezacaftor, underscoring the functional significance of the structural discovery. These results support a mechanism in which the correctors stabilize TMD1 at an early stage of biogenesis, prevent its premature degradation, and thereby allosterically rescuing many disease-causing mutations. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25447.map.gz emd_25447.map.gz | 304.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25447-v30.xml emd-25447-v30.xml emd-25447.xml emd-25447.xml | 14.5 KB 14.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_25447_fsc.xml emd_25447_fsc.xml | 15.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_25447.png emd_25447.png | 149.5 KB | ||
| Filedesc metadata |  emd-25447.cif.gz emd-25447.cif.gz | 6.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25447 http://ftp.pdbj.org/pub/emdb/structures/EMD-25447 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25447 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25447 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_25447_validation.pdf.gz emd_25447_validation.pdf.gz | 686 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_25447_full_validation.pdf.gz emd_25447_full_validation.pdf.gz | 685.6 KB | 表示 | |
| XML形式データ |  emd_25447_validation.xml.gz emd_25447_validation.xml.gz | 14.6 KB | 表示 | |
| CIF形式データ |  emd_25447_validation.cif.gz emd_25447_validation.cif.gz | 19.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25447 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25447 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25447 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25447 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7svdMC  7sv7C  7svrC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-11008 (タイトル: The complex of phosphorylated human cystic fibrosis transmembrane conductance regulator (CFTR) with ATP/Mg and Lumacaftor (VX-809) EMPIAR-11008 (タイトル: The complex of phosphorylated human cystic fibrosis transmembrane conductance regulator (CFTR) with ATP/Mg and Lumacaftor (VX-809)Data size: 5.8 TB Data #1: Unaligned multi-frame micrographs of phosphorylated human cystic fibrosis transmembrane conductance regulator (CFTR) with ATP/Mg and Lumacaftor (VX-809) [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25447.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25447.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | E1371QCFTR/lumacaftor/ATP | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.676 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
+全体 : The complex of phosphorylated human cystic fibrosis transmembrane...
+超分子 #1: The complex of phosphorylated human cystic fibrosis transmembrane...
+分子 #1: Cystic fibrosis transmembrane conductance regulator
+分子 #2: Cystic fibrosis transmembrane conductance regulator
+分子 #3: MAGNESIUM ION
+分子 #4: ADENOSINE-5'-TRIPHOSPHATE
+分子 #5: DODECANE
+分子 #6: DECANE
+分子 #7: CHOLESTEROL
+分子 #8: Lumacaftor
+分子 #9: UNKNOWN ATOM OR ION
+分子 #10: water
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 98.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー