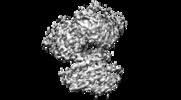
登録情報 データベース : EMDB / ID : EMD-23815タイトル Dimeric (BRAF)2:(14-3-3)2 complex bound to SB590885 Inhibitor Dimeric (B-Raf)2:(14-3-3)2 complex bound to SB590885 Inhibitor 複合体 : Active dimeric (B-Raf)2:(14-3-3)2 complexタンパク質・ペプチド : 14-3-3 protein zeta/deltaタンパク質・ペプチド : Serine/threonine-protein kinase B-rafリガンド : (1Z)-5-(2-{4-[2-(DIMETHYLAMINO)ETHOXY]PHENYL}-5-PYRIDIN-4-YL-1H-IMIDAZOL-4-YL)INDAN-1-ONE OXIME機能・相同性 分子機能 ドメイン・相同性 構成要素
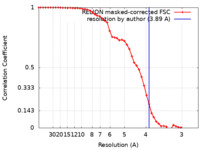
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 3.89 Å Martinez Fiesco JA / Ping Z / Durrant DE / Morrison DK 資金援助 Organization Grant number 国 National Institutes of Health/National Cancer Institute (NIH/NCI) ZIA BC 011744 National Institutes of Health/National Cancer Institute (NIH/NCI) ZIA BC 010329
ジャーナル : Nat Commun / 年 : 2022タイトル : Structural insights into the BRAF monomer-to-dimer transition mediated by RAS binding.著者 : Juliana A Martinez Fiesco / David E Durrant / Deborah K Morrison / Ping Zhang / 要旨 : RAF kinases are essential effectors of RAS, but how RAS binding initiates the conformational changes needed for autoinhibited RAF monomers to form active dimers has remained unclear. Here, we present ... RAF kinases are essential effectors of RAS, but how RAS binding initiates the conformational changes needed for autoinhibited RAF monomers to form active dimers has remained unclear. Here, we present cryo-electron microscopy structures of full-length BRAF complexes derived from mammalian cells: autoinhibited, monomeric BRAF:14-3-3:MEK and BRAF:14-3-3 complexes, and an inhibitor-bound, dimeric BRAF:14-3-3 complex, at 3.7, 4.1, and 3.9 Å resolution, respectively. In both autoinhibited, monomeric structures, the RAS binding domain (RBD) of BRAF is resolved, revealing that the RBD forms an extensive contact interface with the 14-3-3 protomer bound to the BRAF C-terminal site and that key basic residues required for RBD-RAS binding are exposed. Moreover, through structure-guided mutational studies, our findings indicate that RAS-RAF binding is a dynamic process and that RBD residues at the center of the RBD:14-3-3 interface have a dual function, first contributing to RAF autoinhibition and then to the full spectrum of RAS-RBD interactions. 履歴 登録 2021年4月9日 - ヘッダ(付随情報) 公開 2022年1月26日 - マップ公開 2022年1月26日 - 更新 2022年2月9日 - 現状 2022年2月9日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 米国, 2件
米国, 2件  引用
引用 ジャーナル: Nat Commun / 年: 2022
ジャーナル: Nat Commun / 年: 2022
 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_23815.map.gz
emd_23815.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-23815-v30.xml
emd-23815-v30.xml emd-23815.xml
emd-23815.xml EMDBヘッダ
EMDBヘッダ emd_23815_fsc.xml
emd_23815_fsc.xml FSCデータファイル
FSCデータファイル emd_23815.png
emd_23815.png http://ftp.pdbj.org/pub/emdb/structures/EMD-23815
http://ftp.pdbj.org/pub/emdb/structures/EMD-23815 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23815
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23815 emd_23815_validation.pdf.gz
emd_23815_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_23815_full_validation.pdf.gz
emd_23815_full_validation.pdf.gz emd_23815_validation.xml.gz
emd_23815_validation.xml.gz emd_23815_validation.cif.gz
emd_23815_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23815
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23815 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23815
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23815 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_23815.map.gz / 形式: CCP4 / 大きさ: 8.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_23815.map.gz / 形式: CCP4 / 大きさ: 8.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー