+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22106 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | High resolution cryoEM structure of huntingtin in complex with HAP40 | |||||||||
 マップデータ マップデータ | relion local resolution filtered map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Huntingtin / HTT / 40-kDa huntingtin-associated protein / HAP40 / Structural Genomics / Structural Genomics Consortium / SGC / PROTEIN BINDING | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報vesicle cytoskeletal trafficking / regulation of cAMP-dependent protein kinase activity / : / positive regulation of inositol 1,4,5-trisphosphate-sensitive calcium-release channel activity / microtubule-based transport / vocal learning / negative regulation of proteasomal protein catabolic process / regulation of CAMKK-AMPK signaling cascade / positive regulation of mitophagy / profilin binding ...vesicle cytoskeletal trafficking / regulation of cAMP-dependent protein kinase activity / : / positive regulation of inositol 1,4,5-trisphosphate-sensitive calcium-release channel activity / microtubule-based transport / vocal learning / negative regulation of proteasomal protein catabolic process / regulation of CAMKK-AMPK signaling cascade / positive regulation of mitophagy / profilin binding / vesicle transport along microtubule / positive regulation of cilium assembly / retrograde vesicle-mediated transport, Golgi to endoplasmic reticulum / presynaptic cytosol / positive regulation of aggrephagy / positive regulation of lipophagy / dynein intermediate chain binding / postsynaptic cytosol / Golgi organization / beta-tubulin binding / establishment of mitotic spindle orientation / dynactin binding / Regulation of MECP2 expression and activity / inclusion body / heat shock protein binding / autophagosome / centriole / negative regulation of extrinsic apoptotic signaling pathway / protein destabilization / cytoplasmic vesicle membrane / kinase binding / late endosome / p53 binding / transmembrane transporter binding / early endosome / nuclear body / positive regulation of apoptotic process / axon / dendrite / apoptotic process / perinuclear region of cytoplasm / Golgi apparatus / endoplasmic reticulum / protein-containing complex / nucleoplasm / identical protein binding / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
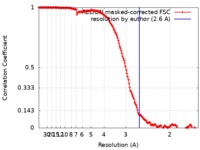
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.6 Å | |||||||||
 データ登録者 データ登録者 | Harding RJ / Deme JC / Lea SM / Arrowsmith CH / Structural Genomics Consortium (SGC) | |||||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2021 ジャーナル: Commun Biol / 年: 2021タイトル: Huntingtin structure is orchestrated by HAP40 and shows a polyglutamine expansion-specific interaction with exon 1. 著者: Rachel J Harding / Justin C Deme / Johannes F Hevler / Sem Tamara / Alexander Lemak / Jeffrey P Cantle / Magdalena M Szewczyk / Nola Begeja / Siobhan Goss / Xiaobing Zuo / Peter Loppnau / ...著者: Rachel J Harding / Justin C Deme / Johannes F Hevler / Sem Tamara / Alexander Lemak / Jeffrey P Cantle / Magdalena M Szewczyk / Nola Begeja / Siobhan Goss / Xiaobing Zuo / Peter Loppnau / Alma Seitova / Ashley Hutchinson / Lixin Fan / Ray Truant / Matthieu Schapira / Jeffrey B Carroll / Albert J R Heck / Susan M Lea / Cheryl H Arrowsmith /     要旨: Huntington's disease results from expansion of a glutamine-coding CAG tract in the huntingtin (HTT) gene, producing an aberrantly functioning form of HTT. Both wildtype and disease-state HTT form a ...Huntington's disease results from expansion of a glutamine-coding CAG tract in the huntingtin (HTT) gene, producing an aberrantly functioning form of HTT. Both wildtype and disease-state HTT form a hetero-dimer with HAP40 of unknown functional relevance. We demonstrate in vivo and in cell models that HTT and HAP40 cellular abundance are coupled. Integrating data from a 2.6 Å cryo-electron microscopy structure, cross-linking mass spectrometry, small-angle X-ray scattering, and modeling, we provide a near-atomic-level view of HTT, its molecular interaction surfaces and compacted domain architecture, orchestrated by HAP40. Native mass spectrometry reveals a remarkably stable hetero-dimer, potentially explaining the cellular inter-dependence of HTT and HAP40. The exon 1 region of HTT is dynamic but shows greater conformational variety in the polyglutamine expanded mutant than wildtype exon 1. Our data provide a foundation for future functional and drug discovery studies targeting Huntington's disease and illuminate the structural consequences of HTT polyglutamine expansion. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22106.map.gz emd_22106.map.gz | 200.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22106-v30.xml emd-22106-v30.xml emd-22106.xml emd-22106.xml | 26.4 KB 26.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_22106_fsc.xml emd_22106_fsc.xml | 15.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_22106.png emd_22106.png | 39.3 KB | ||
| マスクデータ |  emd_22106_msk_1.map emd_22106_msk_1.map | 343 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-22106.cif.gz emd-22106.cif.gz | 8.3 KB | ||
| その他 |  emd_22106_additional_1.map.gz emd_22106_additional_1.map.gz emd_22106_additional_2.map.gz emd_22106_additional_2.map.gz emd_22106_half_map_1.map.gz emd_22106_half_map_1.map.gz emd_22106_half_map_2.map.gz emd_22106_half_map_2.map.gz | 320.2 MB 275 MB 276 MB 275.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22106 http://ftp.pdbj.org/pub/emdb/structures/EMD-22106 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22106 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22106 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_22106_validation.pdf.gz emd_22106_validation.pdf.gz | 861.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_22106_full_validation.pdf.gz emd_22106_full_validation.pdf.gz | 860.8 KB | 表示 | |
| XML形式データ |  emd_22106_validation.xml.gz emd_22106_validation.xml.gz | 23.6 KB | 表示 | |
| CIF形式データ |  emd_22106_validation.cif.gz emd_22106_validation.cif.gz | 31.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22106 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22106 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22106 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22106 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22106.map.gz / 形式: CCP4 / 大きさ: 343 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22106.map.gz / 形式: CCP4 / 大きさ: 343 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | relion local resolution filtered map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.822 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_22106_msk_1.map emd_22106_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: relion postprocessed map
| ファイル | emd_22106_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | relion postprocessed map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: relion auto-refinement map
| ファイル | emd_22106_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | relion auto-refinement map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: relion auto-refinement unfiltered half map 2
| ファイル | emd_22106_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | relion auto-refinement unfiltered half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: relion auto-refinement unfiltered half map 1
| ファイル | emd_22106_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | relion auto-refinement unfiltered half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human huntingtin-HAP40 complex
| 全体 | 名称: Human huntingtin-HAP40 complex |
|---|---|
| 要素 |
|
-超分子 #1: Human huntingtin-HAP40 complex
| 超分子 | 名称: Human huntingtin-HAP40 complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Huntingtin
| 分子 | 名称: Huntingtin / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 349.472344 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MATLEKLMKA FESLKSFQQQ QQQQQQQQQQ QQQQQQQQQQ PPPPPPPPPP PQLPQPPPQA QPLLPQPQPP PPPPPPPPGP AVAEEPLHR PKKELSATKK DRVNHCLTIC ENIVAQSVRN SPEFQKLLGI AMELFLLCSD DAESDVRMVA DECLNKVIKA L MDSNLPRL ...文字列: MATLEKLMKA FESLKSFQQQ QQQQQQQQQQ QQQQQQQQQQ PPPPPPPPPP PQLPQPPPQA QPLLPQPQPP PPPPPPPPGP AVAEEPLHR PKKELSATKK DRVNHCLTIC ENIVAQSVRN SPEFQKLLGI AMELFLLCSD DAESDVRMVA DECLNKVIKA L MDSNLPRL QLELYKEIKK NGAPRSLRAA LWRFAELAHL VRPQKCRPYL VNLLPCLTRT SKRPEESVQE TLAAAVPKIM AS FGNFAND NEIKVLLKAF IANLKSSSPT IRRTAAGSAV SICQHSRRTQ YFYSWLLNVL LGLLVPVEDE HSTLLILGVL LTL RYLVPL LQQQVKDTSL KGSFGVTRKE MEVSPSAEQL VQVYELTLHH TQHQDHNVVT GALELLQQLF RTPPPELLQT LTAV GGIGQ LTAAKEESGG RSRSGSIVEL IAGGGSSCSP VLSRKQKGKV LLGEEEALED DSESRSDVSS SALTASVKDE ISGEL AASS GVSTPGSAGH DIITEQPRSQ HTLQADSVDL ASCDLTSSAT DGDEEDILSH SSSQVSAVPS DPAMDLNDGT QASSPI SDS SQTTTEGPDS AVTPSDSSEI VLDGTDNQYL GLQIGQPQDE DEEATGILPD EASEAFRNSS MALQQAHLLK NMSHCRQ PS DSSVDKFVLR DEATEPGDQE NKPCRIKGDI GQSTDDDSAP LVHCVRLLSA SFLLTGGKNV LVPDRDVRVS VKALALSC V GAAVALHPES FFSKLYKVPL DTTEYPEEQY VSDILNYIDH GDPQVRGATA ILCGTLICSI LSRSRFHVGD WMGTIRTLT GNTFSLADCI PLLRKTLKDE SSVTCKLACT AVRNCVMSLC SSSYSELGLQ LIIDVLTLRN SSYWLVRTEL LETLAEIDFR LVSFLEAKA ENLHRGAHHY TGLLKLQERV LNNVVIHLLG DEDPRVRHVA AASLIRLVPK LFYKCDQGQA DPVVAVARDQ S SVYLKLLM HETQPPSHFS VSTITRIYRG YNLLPSITDV TMENNLSRVI AAVSHELITS TTRALTFGCC EALCLLSTAF PV CIWSLGW HCGVPPLSAS DESRKSCTVG MATMILTLLS SAWFPLDLSA HQDALILAGN LLAASAPKSL RSSWASEEEA NPA ATKQEE VWPALGDRAL VPMVEQLFSH LLKVINICAH VLDDVAPGPA IKAALPSLTN PPSLSPIRRK GKEKEPGEQA SVPL SPKKG SEASAASRQS DTSGPVTTSK SSSLGSFYHL PSYLKLHDVL KATHANYKVT LDLQNSTEKF GGFLRSALDV LSQIL ELAT LQDIGKCVEE ILGYLKSCFS REPMMATVCV QQLLKTLFGT NLASQFDGLS SNPSKSQGRA QRLGSSSVRP GLYHYC FMA PYTHFTQALA DASLRNMVQA EQENDTSGWF DVLQKVSTQL KTNLTSVTKN RADKNAIHNH IRLFEPLVIK ALKQYTT TT CVQLQKQVLD LLAQLVQLRV NYCLLDSDQV FIGFVLKQFE YIEVGQFRES EAIIPNIFFF LVLLSYERYH SKQIIGIP K IIQLCDGIMA SGRKAVTHAI PALQPIVHDL FVLRGTNKAD AGKELETQKE VVVSMLLRLI QYHQVLEMFI LVLQQCHKE NEDKWKRLSR QIADIILPML AKQQMHIDSH EALGVLNTLF EILAPSSLRP VDMLLRSMFV TPNTMASVST VQLWISGILA ILRVLISQS TEDIVLSRIQ ELSFSPYLIS CTVINRLRDG DSTSTLEEHS EGKQIKNLPE ETFSRFLLQL VGILLEDIVT K QLKVEMSE QQHTFYCQEL GTLLMCLIHI FKSGMFRRIT AAATRLFRSD GCGGSFYTLD SLNLRARSMI TTHPALVLLW CQ ILLLVNH TDYRWWAEVQ QTPKRHSLSS TKLLSPQMSG EEEDSDLAAK LGMCNREIVR RGALILFCDY VCQNLHDSEH LTW LIVNHI QDLISLSHEP PVQDFISAVH RNSAASGLFI QAIQSRCENL STPTMLKKTL QCLEGIHLSQ SGAVLTLYVD RLLC TPFRV LARMVDILAC RRVEMLLAAN LQSSMAQLPM EELNRIQEYL QSSGLAQRHQ RLYSLLDRFR LSTMQDSLSP SPPVS SHPL DGDGHVSLET VSPDKDWYVH LVKSQCWTRS DSALLEGAEL VNRIPAEDMN AFMMNSEFNL SLLAPCLSLG MSEISG GQK SALFEAAREV TLARVSGTVQ QLPAVHHVFQ PELPAEPAAY WSKLNDLFGD AALYQSLPTL ARALAQYLVV VSKLPSH LH LPPEKEKDIV KFVVATLEAL SWHLIHEQIP LSLDLQAGLD CCCLALQLPG LWSVVSSTEF VTHACSLIHC VHFILEAV A VQPGEQLLSP ERRTNTPKAI SEEEEEVDPN TQNPKYITAA CEMVAEMVES LQSVLALGHK RNSGVPAFLT PLLRNIIIS LARLPLVNSY TRVPPLVWKL GWSPKPGGDF GTAFPEIPVE FLQEKEVFKE FIYRINTLGW TSRTQFEETW ATLLGVLVTQ PLVMEQEES PPEEDTERTQ INVLAVQAIT SLVLSAMTVP VAGNPAVSCL EQQPRNKPLK ALDTRFGRKL SIIRGIVEQE I QAMVSKRE NIATHHLYQA WDPVPSLSPA TTGALISHEK LLLQINPERE LGSMSYKLGQ VSIHSVWLGN SITPLREEEW DE EEEEEAD APAPSSPPTS PVNSRKHRAG VDIHSCSQFL LELYSRWILP SSSARRTPAI LISEVVRSLL VVSDLFTERN QFE LMYVTL TELRRVHPSE DEILAQYLVP ATCKAAAVLG MDKAVAEPVS RLLESTLRSS HLPSRVGALH GILYVLECDL LDDT AKQLI PVISDYLLSN LKGIAHCVNI HSQQHVLVMC ATAFYLIENY PLDVGPEFSA SIIQMCGVML SGSEESTPSI IYHCA LRGL ERLLLSEQLS RLDAESLVKL SVDRVNVHSP HRAMAALGLM LTCMYTGKEK VSPGRTSDPN PAAPDSESVI VAMERV SVL FDRIRKGFPC EARVVARILP QFLDDFFPPQ DIMNKVIGEF LSNQQPYPQF MATVVYKVFQ TLHSTGQSSM VRDWVML SL SNFTQRAPVA MATWSLSCFF VSASTSPWVA AILPHVISRM GKLEQVDVNL FCLVATDFYR HQIEEELDRR AFQSVLEV V AAPGSPYHRL LTCLRNVHKV TTCGGSGDYK DDDDK UniProtKB: Huntingtin |
-分子 #2: 40-kDa huntingtin-associated protein
| 分子 | 名称: 40-kDa huntingtin-associated protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 41.342254 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MHHHHHHSSG RENLYFQGMA AAAAGLGGGG AGPGPEAGDF LARYRLVSNK LKKRFLRKPN VAEAGEQFGQ LGRELRAQEC LPYAAWCQL AVARCQQALF HGPGEALALT EAARLFLRQE RDARQRLVCP AAYGEPLQAA ASALGAAVRL HLELGQPAAA A ALCLELAA ...文字列: MHHHHHHSSG RENLYFQGMA AAAAGLGGGG AGPGPEAGDF LARYRLVSNK LKKRFLRKPN VAEAGEQFGQ LGRELRAQEC LPYAAWCQL AVARCQQALF HGPGEALALT EAARLFLRQE RDARQRLVCP AAYGEPLQAA ASALGAAVRL HLELGQPAAA A ALCLELAA ALRDLGQPAA AAGHFQRAAQ LQLPQLPLAA LQALGEAASC QLLARDYTGA LAVFTRMQRL AREHGSHPVQ SL PPPPPPA PQPGPGATPA LPAALLPPNS GSAAPSPAAL GAFSDVLVRC EVSRVLLLLL LQPPPAKLLP EHAQTLEKYS WEA FDSHGQ ESSGQLPEEL FLLLQSLVMA THEKDTEAIK SLQVEMWPLL TAEQNHLLHL VLQETISPSG QGV UniProtKB: 40-kDa huntingtin-associated protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| |||||||||||||||
| グリッド | モデル: Quantifoil R2/4 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GRAPHENE / 支持フィルム - トポロジー: CONTINUOUS / 支持フィルム - Film thickness: 0.35 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 10 sec. / 前処理 - 雰囲気: AIR / 詳細: 15 mA | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / 平均露光時間: 8.0 sec. / 平均電子線量: 48.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 165000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)