+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22024 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | hEAAT3-Asymmetric-2o1i-in20mM-Asp | |||||||||
 マップデータ マップデータ | hEAAT3 asymmetric trimer with 2 outward-facing protomers and 1 inward-facing protomer in 20mM Asp | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報D-aspartate transmembrane transport / regulation of protein targeting to membrane / D-aspartate transmembrane transporter activity / Defective SLC1A1 is implicated in schizophrenia 18 (SCZD18) and dicarboxylic aminoaciduria (DCBXA) / distal dendrite / response to anesthetic / cysteine transmembrane transporter activity / cysteine transport / high-affinity L-glutamate transmembrane transporter activity / glutamate:sodium symporter activity ...D-aspartate transmembrane transport / regulation of protein targeting to membrane / D-aspartate transmembrane transporter activity / Defective SLC1A1 is implicated in schizophrenia 18 (SCZD18) and dicarboxylic aminoaciduria (DCBXA) / distal dendrite / response to anesthetic / cysteine transmembrane transporter activity / cysteine transport / high-affinity L-glutamate transmembrane transporter activity / glutamate:sodium symporter activity / L-glutamate import / neurotransmitter receptor transport to plasma membrane / response to decreased oxygen levels / cellular response to mercury ion / Transport of inorganic cations/anions and amino acids/oligopeptides / retina layer formation / L-glutamate transmembrane transport / L-glutamate transmembrane transporter activity / zinc ion transmembrane transport / cellular response to bisphenol A / L-aspartate transmembrane transport / glutathione biosynthetic process / cellular response to ammonium ion / D-aspartate import across plasma membrane / righting reflex / monoatomic anion channel activity / L-aspartate transmembrane transporter activity / L-aspartate import across plasma membrane / grooming behavior / intracellular glutamate homeostasis / Glutamate Neurotransmitter Release Cycle / proximal dendrite / L-glutamate import across plasma membrane / transepithelial transport / apical dendrite / conditioned place preference / intracellular zinc ion homeostasis / cellular response to cocaine / blood vessel morphogenesis / neurotransmitter transport / motor behavior / motor neuron apoptotic process / response to morphine / chloride transmembrane transporter activity / glutamate receptor signaling pathway / glutamate binding / G protein-coupled dopamine receptor signaling pathway / positive regulation of heart rate / postsynaptic modulation of chemical synaptic transmission / maintenance of blood-brain barrier / superoxide metabolic process / heart contraction / adult behavior / perisynaptic space / dopamine metabolic process / glial cell projection / cellular response to organic cyclic compound / asymmetric synapse / transport across blood-brain barrier / response to axon injury / behavioral fear response / synaptic cleft / monoatomic ion transport / axon terminus / chloride transmembrane transport / response to amphetamine / neurogenesis / dendritic shaft / cell periphery / locomotory behavior / long-term synaptic potentiation / synapse organization / regulation of protein phosphorylation / brain development / Schaffer collateral - CA1 synapse / memory / cytokine-mediated signaling pathway / recycling endosome membrane / late endosome membrane / presynapse / cellular response to oxidative stress / gene expression / early endosome membrane / chemical synaptic transmission / perikaryon / negative regulation of neuron apoptotic process / dendritic spine / response to xenobiotic stimulus / membrane raft / apical plasma membrane / axon / neuronal cell body / dendrite / cell surface / endoplasmic reticulum / extracellular exosome / identical protein binding / membrane / metal ion binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.71 Å | |||||||||
 データ登録者 データ登録者 | Qiu B / Matthies D / Boudker O | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2021 ジャーナル: Sci Adv / 年: 2021タイトル: Cryo-EM structures of excitatory amino acid transporter 3 visualize coupled substrate, sodium, and proton binding and transport. 著者: Biao Qiu / Doreen Matthies / Eva Fortea / Zhiheng Yu / Olga Boudker /  要旨: Human excitatory amino acid transporter 3 (hEAAT3) mediates glutamate uptake in neurons, intestine, and kidney. Here, we report cryo-EM structures of hEAAT3 in several functional states where the ...Human excitatory amino acid transporter 3 (hEAAT3) mediates glutamate uptake in neurons, intestine, and kidney. Here, we report cryo-EM structures of hEAAT3 in several functional states where the transporter is empty, bound to coupled sodium ions only, or fully loaded with three sodium ions, a proton, and the substrate aspartate. The structures suggest that hEAAT3 operates by an elevator mechanism involving three functionally independent subunits. When the substrate-binding site is near the cytoplasm, it has a remarkably low affinity for the substrate, perhaps facilitating its release and allowing the rapid transport turnover. The mechanism of the coupled uptake of the sodium ions and the substrate is conserved across evolutionarily distant families and is augmented by coupling to protons in EAATs. The structures further suggest a mechanism by which a conserved glutamate residue mediates proton symport. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22024.map.gz emd_22024.map.gz | 37.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22024-v30.xml emd-22024-v30.xml emd-22024.xml emd-22024.xml | 12.8 KB 12.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_22024_fsc.xml emd_22024_fsc.xml | 7.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_22024.png emd_22024.png | 40.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22024 http://ftp.pdbj.org/pub/emdb/structures/EMD-22024 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22024 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22024 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_22024_validation.pdf.gz emd_22024_validation.pdf.gz | 389.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_22024_full_validation.pdf.gz emd_22024_full_validation.pdf.gz | 389.2 KB | 表示 | |
| XML形式データ |  emd_22024_validation.xml.gz emd_22024_validation.xml.gz | 10 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22024 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22024 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22024 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22024 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22024.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22024.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | hEAAT3 asymmetric trimer with 2 outward-facing protomers and 1 inward-facing protomer in 20mM Asp | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.096 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
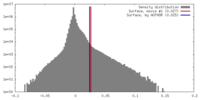
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : human Excitatory amino acid transporter 3 in 20mM Asp
| 全体 | 名称: human Excitatory amino acid transporter 3 in 20mM Asp |
|---|---|
| 要素 |
|
-超分子 #1: human Excitatory amino acid transporter 3 in 20mM Asp
| 超分子 | 名称: human Excitatory amino acid transporter 3 in 20mM Asp タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: human Excitatory amino acid transporter 3
| 分子 | 名称: human Excitatory amino acid transporter 3 / タイプ: protein_or_peptide / ID: 1 詳細: The Glycine and Proline at the N terminal are the residues left after PreScission Protease treatment 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GPMGKPARKG CEWKRFLKNN WVLLSTVAAV VLGITTGVLV REHSNLSTLE KFYFAFPGEI LMRMLKLIIL PL IISSMIT GVAALDSNVS GKIGLRAVVY YFCTTLIAVI LGIVLVVSIK PGVTQKVGEI ARTGSTPEVS TVD AMLDLI RNMFPENLVQ ACFQQYKTKR ...文字列: GPMGKPARKG CEWKRFLKNN WVLLSTVAAV VLGITTGVLV REHSNLSTLE KFYFAFPGEI LMRMLKLIIL PL IISSMIT GVAALDSNVS GKIGLRAVVY YFCTTLIAVI LGIVLVVSIK PGVTQKVGEI ARTGSTPEVS TVD AMLDLI RNMFPENLVQ ACFQQYKTKR EEVKPPSDPE MNMTEESFTA VMTTAISKNK TKEYKIVGMY SDGI NVLGL IVFCLVFGLV IGKMGEKGQI LVDFFNALSD ATMKIVQIIM CYMPLGILFL IAGKIIEVED WEIFR KLGL YMATVLTGLA IHSIVILPLI YFIVVRKNPF RFAMGMAQAL LTALMISSSS ATLPVTFRCA EENNQV DKR ITRFVLPVGA TINMDGTALY EAVAAVFIAQ LNDLDLGIGQ IITISITATS ASIGAAGVPQ AGLVTMV IV LSAVGLPAED VTLIIAVDWL LDRFRTMVNV LGDAFGTGIV EKLSKKELEQ MDVSSEVNIV NPFALEST I LDNEDSDTKK SYVNGGFAVD KSDTISFTQT SQF |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| ||||||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均露光時間: 10.0 sec. / 平均電子線量: 67.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 0.001 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)