+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22004 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | +3 extended HIV-1 reverse transcriptase initiation complex (intermediate state, unmasked map) | |||||||||
 マップデータ マップデータ | +3 extended HIV-1 reverse transcriptase initiation complex | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) / Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) /  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.3 Å | |||||||||
 データ登録者 データ登録者 | Larsen KP / Jackson LN / Zhang J / Puglisi EV | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2020 ジャーナル: J Mol Biol / 年: 2020タイトル: Distinct Conformational States Underlie Pausing during Initiation of HIV-1 Reverse Transcription. 著者: Kevin P Larsen / Junhong Choi / Lynnette N Jackson / Kalli Kappel / Jingji Zhang / Betty Ha / Dong-Hua Chen / Elisabetta Viani Puglisi /  要旨: A hallmark of the initiation step of HIV-1 reverse transcription, in which viral RNA genome is converted into double-stranded DNA, is that it is slow and non-processive. Biochemical studies have ...A hallmark of the initiation step of HIV-1 reverse transcription, in which viral RNA genome is converted into double-stranded DNA, is that it is slow and non-processive. Biochemical studies have identified specific sites along the viral RNA genomic template in which reverse transcriptase (RT) stalls. These stalling points, which occur after the addition of three and five template dNTPs, may serve as checkpoints to regulate the precise timing of HIV-1 reverse transcription following viral entry. Structural studies of reverse transcriptase initiation complexes (RTICs) have revealed unique conformations that may explain the slow rate of incorporation; however, questions remain about the temporal evolution of the complex and features that contribute to strong pausing during initiation. Here we present cryo-electron microscopy and single-molecule characterization of an RTIC after three rounds of dNTP incorporation (+3), the first major pausing point during reverse transcription initiation. Cryo-electron microscopy structures of a +3 extended RTIC reveal conformational heterogeneity within the RTIC core. Three distinct conformations were identified, two of which adopt unique, likely off-pathway, intermediates in the canonical polymerization cycle. Single-molecule Förster resonance energy transfer experiments confirm that the +3 RTIC is more structurally dynamic than earlier-stage RTICs. These alternative conformations were selectively disrupted through structure-guided point mutations to shift single-molecule Förster resonance energy transfer populations back toward the on-pathway conformation. Our results support the hypothesis that conformational heterogeneity within the HIV-1 RTIC during pausing serves as an additional means of regulating HIV-1 replication. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22004.map.gz emd_22004.map.gz | 59.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22004-v30.xml emd-22004-v30.xml emd-22004.xml emd-22004.xml | 14.4 KB 14.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_22004.png emd_22004.png | 28 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22004 http://ftp.pdbj.org/pub/emdb/structures/EMD-22004 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22004 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22004 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_22004_validation.pdf.gz emd_22004_validation.pdf.gz | 78.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_22004_full_validation.pdf.gz emd_22004_full_validation.pdf.gz | 77.3 KB | 表示 | |
| XML形式データ |  emd_22004_validation.xml.gz emd_22004_validation.xml.gz | 493 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22004 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22004 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22004 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22004 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22004.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22004.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | +3 extended HIV-1 reverse transcriptase initiation complex | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
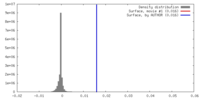
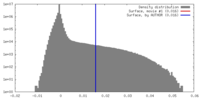
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : +3 extended HIV-1 reverse transcriptase initiation complex (inter...
| 全体 | 名称: +3 extended HIV-1 reverse transcriptase initiation complex (intermediate state) |
|---|---|
| 要素 |
|
-超分子 #1: +3 extended HIV-1 reverse transcriptase initiation complex (inter...
| 超分子 | 名称: +3 extended HIV-1 reverse transcriptase initiation complex (intermediate state) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) |
| 組換発現 | 生物種:  |
| 分子量 | 理論値: 25 KDa |
-超分子 #2: HIV-1 reverse transcriptase
| 超分子 | 名称: HIV-1 reverse transcriptase / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1-#2 詳細: The C-terminus of p66 contains an unstructured linker and a six-histidine tag that was cleaved prior to full complex formation. |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) |
| 組換発現 | 生物種:  |
-超分子 #3: HIV-1 RNA genome fragment
| 超分子 | 名称: HIV-1 RNA genome fragment / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #3 詳細: A fragment of the HIV-1 RNA genome that is 101 nucleotides in length. |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) |
| 組換発現 | 生物種:  |
-超分子 #4: tRNA lysine 3
| 超分子 | 名称: tRNA lysine 3 / タイプ: complex / ID: 4 / 親要素: 1 / 含まれる分子: #4 詳細: Chemically synthesized and extended tRNA lysine 3. A modified dG containing an N2-cystamine was placed at position 71 and the sequence was extended on the 3' end by a dC, dT, and ddG to bring ...詳細: Chemically synthesized and extended tRNA lysine 3. A modified dG containing an N2-cystamine was placed at position 71 and the sequence was extended on the 3' end by a dC, dT, and ddG to bring its total length to 79 nucleotides. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5.0 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
詳細: Full complex was prepared 5-8 hours before freezing. Beta-OG was added just prior to freezing. | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 292 K / 装置: LEICA EM GP / 詳細: 3 microliters applied, 2s pre-blot, 2.5s blot.. | |||||||||||||||
| 詳細 | Sample was monodisperse. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 77.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)