+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-21849 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human V-ATPase in state 3 with SidK and ADP | |||||||||
 マップデータ マップデータ | Human V-ATPase in state 3 (composite map) | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | pump / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Blockage of phagosome acidification / proton-transporting two-sector ATPase complex / Ion channel transport / plasma membrane proton-transporting V-type ATPase complex / Regulation of MITF-M-dependent genes involved in lysosome biogenesis and autophagy / intracellular pH reduction / symbiont-mediated suppression of host phagosome acidification / Nef Mediated CD8 Down-regulation / eye pigmentation / central nervous system maturation ...Blockage of phagosome acidification / proton-transporting two-sector ATPase complex / Ion channel transport / plasma membrane proton-transporting V-type ATPase complex / Regulation of MITF-M-dependent genes involved in lysosome biogenesis and autophagy / intracellular pH reduction / symbiont-mediated suppression of host phagosome acidification / Nef Mediated CD8 Down-regulation / eye pigmentation / central nervous system maturation / ATPase-coupled ion transmembrane transporter activity / rostrocaudal neural tube patterning / positive regulation of transforming growth factor beta1 production / Golgi lumen acidification / synaptic vesicle lumen acidification / vacuolar transport / proton-transporting V-type ATPase, V0 domain / extrinsic component of synaptic vesicle membrane / Transferrin endocytosis and recycling / cellular response to increased oxygen levels / vacuolar proton-transporting V-type ATPase, V1 domain / vacuolar proton-transporting V-type ATPase, V0 domain / endosome to plasma membrane protein transport / clathrin-coated vesicle membrane / lysosomal lumen acidification / endosomal lumen acidification / XBP1(S) activates chaperone genes / proton-transporting V-type ATPase complex / Amino acids regulate mTORC1 / head morphogenesis / protein localization to cilium / vacuolar proton-transporting V-type ATPase complex / osteoclast development / Nef Mediated CD4 Down-regulation / vacuolar acidification / ROS and RNS production in phagocytes / regulation of cellular pH / dendritic spine membrane / azurophil granule membrane / proton transmembrane transporter activity / microvillus / ATPase activator activity / regulation of MAPK cascade / tertiary granule membrane / autophagosome membrane / ficolin-1-rich granule membrane / proton-transporting ATPase activity, rotational mechanism / cilium assembly / RHOA GTPase cycle / regulation of macroautophagy / positive regulation of Wnt signaling pathway / transporter activator activity / H+-transporting two-sector ATPase / ATP metabolic process / specific granule membrane / Metabolism of Angiotensinogen to Angiotensins / angiotensin maturation / Insulin receptor recycling / enzyme regulator activity / ruffle / receptor-mediated endocytosis of virus by host cell / proton-transporting ATP synthase activity, rotational mechanism / axon terminus / endoplasmic reticulum-Golgi intermediate compartment membrane / RNA endonuclease activity / proton transmembrane transport / receptor-mediated endocytosis / secretory granule / secretory granule membrane / transmembrane transport / small GTPase binding / endocytosis / phagocytic vesicle membrane / apical part of cell / synaptic vesicle membrane / melanosome / positive regulation of canonical Wnt signaling pathway / signaling receptor activity / ATPase binding / 加水分解酵素; エステル加水分解酵素 / intracellular iron ion homeostasis / postsynaptic membrane / early endosome / lysosome / endosome / endosome membrane / nuclear speck / cilium / apical plasma membrane / axon / Golgi membrane / lysosomal membrane / external side of plasma membrane / focal adhesion / intracellular membrane-bounded organelle / ubiquitin protein ligase binding / Neutrophil degranulation / centrosome / endoplasmic reticulum membrane / protein-containing complex binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Wang L / Wu H | |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2020 ジャーナル: Mol Cell / 年: 2020タイトル: Structures of a Complete Human V-ATPase Reveal Mechanisms of Its Assembly. 著者: Longfei Wang / Di Wu / Carol V Robinson / Hao Wu / Tian-Min Fu /   要旨: Vesicular- or vacuolar-type adenosine triphosphatases (V-ATPases) are ATP-driven proton pumps comprised of a cytoplasmic V complex for ATP hydrolysis and a membrane-embedded V complex for proton ...Vesicular- or vacuolar-type adenosine triphosphatases (V-ATPases) are ATP-driven proton pumps comprised of a cytoplasmic V complex for ATP hydrolysis and a membrane-embedded V complex for proton transfer. They play important roles in acidification of intracellular vesicles, organelles, and the extracellular milieu in eukaryotes. Here, we report cryoelectron microscopy structures of human V-ATPase in three rotational states at up to 2.9-Å resolution. Aided by mass spectrometry, we build all known protein subunits with associated N-linked glycans and identify glycolipids and phospholipids in the V complex. We define ATP6AP1 as a structural hub for V complex assembly because it connects to multiple V subunits and phospholipids in the c-ring. The glycolipids and the glycosylated V subunits form a luminal glycan coat critical for V-ATPase folding, localization, and stability. This study identifies mechanisms of V-ATPase assembly and biogenesis that rely on the integrated roles of ATP6AP1, glycans, and lipids. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_21849.map.gz emd_21849.map.gz | 165.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-21849-v30.xml emd-21849-v30.xml emd-21849.xml emd-21849.xml | 30.3 KB 30.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_21849.png emd_21849.png | 59.2 KB | ||
| Filedesc metadata |  emd-21849.cif.gz emd-21849.cif.gz | 9.4 KB | ||
| その他 |  emd_21849_additional_1.map.gz emd_21849_additional_1.map.gz | 165.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-21849 http://ftp.pdbj.org/pub/emdb/structures/EMD-21849 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21849 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21849 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_21849_validation.pdf.gz emd_21849_validation.pdf.gz | 650 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_21849_full_validation.pdf.gz emd_21849_full_validation.pdf.gz | 649.6 KB | 表示 | |
| XML形式データ |  emd_21849_validation.xml.gz emd_21849_validation.xml.gz | 7.2 KB | 表示 | |
| CIF形式データ |  emd_21849_validation.cif.gz emd_21849_validation.cif.gz | 8.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21849 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21849 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21849 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21849 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6wm4MC  6wlwC  6wlzC  6wm2C  6wm3C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-11132 (タイトル: Cryo-EM structures of human V-ATPase / Data size: 8.4 TB EMPIAR-11132 (タイトル: Cryo-EM structures of human V-ATPase / Data size: 8.4 TBData #1: Unaligned multi frame micrographs of human V-ATPase in complex with SidK [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_21849.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_21849.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Human V-ATPase in state 3 (composite map) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
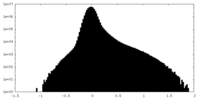
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: Human V-ATPase in state 3
| ファイル | emd_21849_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Human V-ATPase in state 3 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
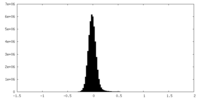
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Human V-ATPase with SidK and ADP
+超分子 #1: Human V-ATPase with SidK and ADP
+分子 #1: V-type proton ATPase 116 kDa subunit a isoform 1
+分子 #2: V-type proton ATPase subunit C 1
+分子 #3: V-type proton ATPase subunit E 1
+分子 #4: V-type proton ATPase subunit G 1
+分子 #5: V-type proton ATPase subunit e 1
+分子 #6: Ribonuclease kappa
+分子 #7: V-type proton ATPase catalytic subunit A
+分子 #8: V-type proton ATPase subunit B, brain isoform
+分子 #9: SidK
+分子 #10: V-type proton ATPase subunit D
+分子 #11: V-type proton ATPase subunit F
+分子 #12: V-type proton ATPase subunit S1
+分子 #13: Renin receptor
+分子 #14: V-type proton ATPase 21 kDa proteolipid subunit
+分子 #15: V-type proton ATPase 16 kDa proteolipid subunit
+分子 #16: V-type proton ATPase subunit d 1
+分子 #17: V-type proton ATPase subunit H
+分子 #18: 2-acetamido-2-deoxy-beta-D-glucopyranose
+分子 #19: ADENOSINE-5'-DIPHOSPHATE
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.1 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 1000000 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
 ムービー
ムービー コントローラー
コントローラー






























 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)