[日本語] English
 万見
万見- EMDB-20354: cryoEM structure of the substrate-bound human CTP synthase 2 filament -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-20354 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | cryoEM structure of the substrate-bound human CTP synthase 2 filament | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Enzyme / filament / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoophidium / CTP synthase (glutamine hydrolysing) / CTP synthase activity / pyrimidine nucleotide metabolic process / 'de novo' CTP biosynthetic process / pyrimidine nucleobase biosynthetic process / Interconversion of nucleotide di- and triphosphates / CTP biosynthetic process / glutamine metabolic process / ATP binding ...cytoophidium / CTP synthase (glutamine hydrolysing) / CTP synthase activity / pyrimidine nucleotide metabolic process / 'de novo' CTP biosynthetic process / pyrimidine nucleobase biosynthetic process / Interconversion of nucleotide di- and triphosphates / CTP biosynthetic process / glutamine metabolic process / ATP binding / identical protein binding / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||
 データ登録者 データ登録者 | Lynch EM / Kollman JM | |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2020 ジャーナル: Nat Struct Mol Biol / 年: 2020タイトル: Coupled structural transitions enable highly cooperative regulation of human CTPS2 filaments. 著者: Eric M Lynch / Justin M Kollman /  要旨: Many enzymes assemble into defined oligomers, providing a mechanism for cooperatively regulating activity. Recent studies have described a mode of regulation in which enzyme activity is modulated by ...Many enzymes assemble into defined oligomers, providing a mechanism for cooperatively regulating activity. Recent studies have described a mode of regulation in which enzyme activity is modulated by polymerization into large-scale filaments. Here we describe an ultrasensitive form of polymerization-based regulation employed by human CTP synthase 2 (CTPS2). Cryo-EM structures reveal that CTPS2 filaments dynamically switch between active and inactive forms in response to changes in substrate and product levels. Linking the conformational state of many CTPS2 subunits in a filament results in highly cooperative regulation, greatly exceeding the limits of cooperativity for the CTPS2 tetramer alone. The structures reveal a link between conformation and control of ammonia channeling between the enzyme's active sites, and explain differences in regulation of human CTPS isoforms. This filament-based mechanism of enhanced cooperativity demonstrates how the widespread phenomenon of enzyme polymerization can be adapted to achieve different regulatory outcomes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_20354.map.gz emd_20354.map.gz | 95.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-20354-v30.xml emd-20354-v30.xml emd-20354.xml emd-20354.xml | 10.1 KB 10.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_20354.png emd_20354.png | 245.4 KB | ||
| Filedesc metadata |  emd-20354.cif.gz emd-20354.cif.gz | 5.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-20354 http://ftp.pdbj.org/pub/emdb/structures/EMD-20354 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20354 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20354 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_20354_validation.pdf.gz emd_20354_validation.pdf.gz | 644.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_20354_full_validation.pdf.gz emd_20354_full_validation.pdf.gz | 644.5 KB | 表示 | |
| XML形式データ |  emd_20354_validation.xml.gz emd_20354_validation.xml.gz | 6.6 KB | 表示 | |
| CIF形式データ |  emd_20354_validation.cif.gz emd_20354_validation.cif.gz | 7.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20354 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20354 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20354 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20354 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_20354.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_20354.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
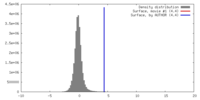
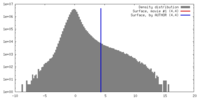
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : substrate-bound CTP synthase 2 filament
| 全体 | 名称: substrate-bound CTP synthase 2 filament |
|---|---|
| 要素 |
|
-超分子 #1: substrate-bound CTP synthase 2 filament
| 超分子 | 名称: substrate-bound CTP synthase 2 filament / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: CTP synthase 2
| 分子 | 名称: CTP synthase 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: CTP synthase (glutamine hydrolysing) |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 65.75943 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKYILVTGGV ISGIGKGIIA SSIGTILKSC GLRVTAIKID PYINIDAGTF SPYEHGEVFV LNDGGEVDLD LGNYERFLDI NLYKDNNIT TGKIYQHVIN KERRGDYLGK TVQVVPHITD AVQEWVMNQA KVPVDGNKEE PQICVIELGG TIGDIEGMPF V EAFRQFQF ...文字列: MKYILVTGGV ISGIGKGIIA SSIGTILKSC GLRVTAIKID PYINIDAGTF SPYEHGEVFV LNDGGEVDLD LGNYERFLDI NLYKDNNIT TGKIYQHVIN KERRGDYLGK TVQVVPHITD AVQEWVMNQA KVPVDGNKEE PQICVIELGG TIGDIEGMPF V EAFRQFQF KAKRENFCNI HVSLVPQLSA TGEQKTKPTQ NSVRALRGLG LSPDLIVCRS STPIEMAVKE KISMFCHVNP EQ VICIHDV SSTYRVPVLL EEQSIVKYFK ERLHLPIGDS ASNLLFKWRN MADRYERLQK ICSIALVGKY TKLRDCYASV FKA LEHSAL AINHKLNLMY IDSIDLEKIT ETEDPVKFHE AWQKLCKADG ILVPGGFGIR GTLGKLQAIS WARTKKIPFL GVCL GMQLA VIEFARNCLN LKDADSTEFR PNAPVPLVID MPEHNPGNLG GTMRLGIRRT VFKTENSILR KLYGDVPFIE ERHRH RFEV NPNLIKQFEQ NDLSFVGQDV DGDRMEIIEL ANHPYFVGVQ FHPEFSSRPM KPSPPYLGLL LAATGNLNAY LQQGCK LSS SDRYSDASDD SFSEPRIAEL EIS UniProtKB: CTP synthase 2 |
-分子 #2: URIDINE 5'-TRIPHOSPHATE
| 分子 | 名称: URIDINE 5'-TRIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 4 / 式: UTP |
|---|---|
| 分子量 | 理論値: 484.141 Da |
| Chemical component information |  ChemComp-UTP: |
-分子 #3: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 4 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.9 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / 平均電子線量: 90.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: INSILICO MODEL |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: D2 (2回x2回 2面回転対称) 解像度のタイプ: BY AUTHOR / 解像度: 3.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cisTEM / 使用した粒子像数: 53964 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: RELION |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cisTEM |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)