+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1wci | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Reactivity modulation of human branched-chain alpha-ketoacid dehydrogenase by an internal molecular switch | ||||||
 要素 要素 | (2-OXOISOVALERATE DEHYDROGENASE ...) x 2 | ||||||
 キーワード キーワード | OXIDOREDUCTASE / KETOACID DEHYDROGENASE / BRANCHED-CHAIN / MULTI ENZYME COMPLEX / ACYLATION / OXIDATIVE DECARBOXYLATION / MAPLE SYRUP URINE DISEASE / THIAMINE DIPHOSPHATE / PHOSPHORYLATION / CONFORMATIONAL SWITCH / REACTIVITY / FLAVOPROTEIN / MAPLE SYRU URINE DISEASE / MITOCHONDRION / THIAMINE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Loss-of-function mutations in BCKDHA or BCKDHB cause MSUD / 3-methyl-2-oxobutanoate dehydrogenase (2-methylpropanoyl-transferring) / branched-chain 2-oxo acid dehydrogenase activity / BCKDH synthesizes BCAA-CoA from KIC, KMVA, KIV / Loss-of-function mutations in DBT cause MSUD2 / Loss-of-function mutations in DLD cause MSUD3/DLDD / H139Hfs13* PPM1K causes a mild variant of MSUD / branched-chain alpha-ketoacid dehydrogenase complex / Branched-chain ketoacid dehydrogenase kinase deficiency / branched-chain amino acid catabolic process ...Loss-of-function mutations in BCKDHA or BCKDHB cause MSUD / 3-methyl-2-oxobutanoate dehydrogenase (2-methylpropanoyl-transferring) / branched-chain 2-oxo acid dehydrogenase activity / BCKDH synthesizes BCAA-CoA from KIC, KMVA, KIV / Loss-of-function mutations in DBT cause MSUD2 / Loss-of-function mutations in DLD cause MSUD3/DLDD / H139Hfs13* PPM1K causes a mild variant of MSUD / branched-chain alpha-ketoacid dehydrogenase complex / Branched-chain ketoacid dehydrogenase kinase deficiency / branched-chain amino acid catabolic process / Branched-chain amino acid catabolism / carboxy-lyase activity / response to nutrient / lipid metabolic process / mitochondrial matrix / nucleolus / mitochondrion / nucleoplasm / metal ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.84 Å 分子置換 / 解像度: 1.84 Å | ||||||
 データ登録者 データ登録者 | Machius, M. / Wynn, R.M. / Chuang, J.L. / Tomchick, D.R. / Brautigam, C.A. / Chuang, D.T. | ||||||
 引用 引用 |  ジャーナル: Structure / 年: 2006 ジャーナル: Structure / 年: 2006タイトル: A Versatile Conformational Switch Regulates Reactivity in Human Branched-Chain Alpha-Ketoacid Dehydrogenase. 著者: Machius, M. / Wynn, R.M. / Chuang, J.L. / Li, J. / Kluger, R. / Yu, D. / Tomchick, D.R. / Brautigam, C.A. / Chuang, D.T. #1:  ジャーナル: J.Biol.Chem. / 年: 2004 ジャーナル: J.Biol.Chem. / 年: 2004タイトル: Crosstalk between Cofactor Binding and the Phosphorylation Loop Conformation in the Bckd Machine 著者: Li, J. / Wynn, R.M. / Machius, M. / Chuang, J.L. / Karthikeyan, S. / Tomchick, D.R. / Chuang, D.T. #2:  ジャーナル: J.Biol.Chem. / 年: 2003 ジャーナル: J.Biol.Chem. / 年: 2003タイトル: Roles of His291-Alpha and His146-Beta in the Reductive Acylation Reaction Catalyzed by Human Branched-Chain Alpha-Ketoacid Dehydrogenase: Refined Phosphorylation Loop Structure in the Active Site 著者: Wynn, R. / Machius, M. / Chuang, J. / Li, J. / Tomchick, D. / Chuang, D. #3: ジャーナル: J.Biol.Chem. / 年: 2001 タイトル: Roles of Active Site and Novel K+ Ion-Binding Site Residues in Human Mitochondrial Branched-Chain Alpha-Ketoacid Decarboxylase/Dehydrogenase 著者: Wynn, R.M. / Ho, R. / Chuang, J.L. / Chuang, D.T. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1wci.cif.gz 1wci.cif.gz | 176.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1wci.ent.gz pdb1wci.ent.gz | 136.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1wci.json.gz 1wci.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/wc/1wci https://data.pdbj.org/pub/pdb/validation_reports/wc/1wci ftp://data.pdbj.org/pub/pdb/validation_reports/wc/1wci ftp://data.pdbj.org/pub/pdb/validation_reports/wc/1wci | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
-2-OXOISOVALERATE DEHYDROGENASE ... , 2種, 2分子 AB
| #1: タンパク質 | 分子量: 45571.098 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  HOMO SAPIENS (ヒト) / 解説: BL-21 CELLS WITH OVEREXPRESSING GROEL AND GROES / プラスミド: PTRC-ALPHA-BETAHIS / 発現宿主: HOMO SAPIENS (ヒト) / 解説: BL-21 CELLS WITH OVEREXPRESSING GROEL AND GROES / プラスミド: PTRC-ALPHA-BETAHIS / 発現宿主:  参照: UniProt: P12694, 3-methyl-2-oxobutanoate dehydrogenase (2-methylpropanoyl-transferring) |
|---|---|
| #2: タンパク質 | 分子量: 37902.270 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  HOMO SAPIENS (ヒト) / 解説: BL-21 CELLS WITH OVEREXPRESSING GROEL AND GROES / プラスミド: PTRC-ALPHA-BETAHIS / 発現宿主: HOMO SAPIENS (ヒト) / 解説: BL-21 CELLS WITH OVEREXPRESSING GROEL AND GROES / プラスミド: PTRC-ALPHA-BETAHIS / 発現宿主:  参照: UniProt: P21953, 3-methyl-2-oxobutanoate dehydrogenase (2-methylpropanoyl-transferring) |
-非ポリマー , 6種, 613分子 
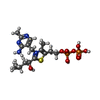









| #3: 化合物 | | #4: 化合物 | ChemComp-WWF / | #5: 化合物 | #6: 化合物 | ChemComp-MN / | #7: 化合物 | #8: 水 | ChemComp-HOH / | |
|---|
-詳細
| 構成要素の詳細 | CATALYTIC ACTIVITY: 3-METHYL-2-OXOBUTANOATE + [DIHYDROLIPOYLLYSINE-RESIDUE (2-METHYLPROPANOYL) ...CATALYTIC ACTIVITY: 3-METHYL-2-OXOBUTANOA |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.5 Å3/Da / 溶媒含有率: 53.4 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法 / pH: 5.5 詳細: CRYSTALS WERE GROWN AT 20C VIA THE VAPOR DIFFUSION METHOD BY MIXING EQUAL AMOUNTS OF PROTEIN (20-25 MG/ML IN 50 MM HEPES/NAOH, PH 7.5, 250 MM KCL, 0.5 MM PMSF, 1 MM BENZAMIDINE AND 5% (V/V) ...詳細: CRYSTALS WERE GROWN AT 20C VIA THE VAPOR DIFFUSION METHOD BY MIXING EQUAL AMOUNTS OF PROTEIN (20-25 MG/ML IN 50 MM HEPES/NAOH, PH 7.5, 250 MM KCL, 0.5 MM PMSF, 1 MM BENZAMIDINE AND 5% (V/V) GLYCEROL) WITH WELL SOLUTION (1.4-1.6 M AMMONIUM SULFATE, 0.1 M NA-CITRATE PH 5.8, 20 MM B-MERCAPTOETHANOL). SERIALLY DILUTED CRUSHED CRYSTALS WERE USED FOR MICRO-SEEDING ONE DAY AFTER THE DROPS WERE SET UP. CRYSTALS APPEARED ONE DAY AFTER SEEDING AND GREW TO A MAXIMUM SIZE OF 120 X 800 UM WITHIN 10 DAYS. CRYSTALS WERE STABILIZED FOR 12 HOURS BY TRANSFER TO FRESH WELL SOLUTION. THEY WERE THEN CRYO-PROTECTED BY STEP-WISE TRANSFER INTO CRYO-BUFFER CONTAINING 1.6 M AMMONIUM SULFATE, 50 MM HEPES, PH 7.5, 100 MM NA-CITRATE, PH 5.8, 100 MM KCL, 50 MM DTT AND UP TO 20% (V/V) GLYCEROL. IT WAS FOUND THAT MN2 IONS COULD REPLACE THE MG2 REQUIRED FOR THE BINDING OF THDP TO THE ENZYME. |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 19-BM / 波長: 1.00691 / ビームライン: 19-BM / 波長: 1.00691 |
| 検出器 | タイプ: CUSTOM / 検出器: CCD / 日付: 2003年6月21日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.00691 Å / 相対比: 1 |
| 反射 | 解像度: 1.84→22.83 Å / Num. obs: 71058 / % possible obs: 97.3 % / Observed criterion σ(I): -3 / 冗長度: 6 % / Biso Wilson estimate: 18.23 Å2 / Rmerge(I) obs: 0.08 / Net I/σ(I): 22.5 |
| 反射 シェル | 解像度: 1.84→1.87 Å / 冗長度: 5.2 % / Rmerge(I) obs: 0.8 / Mean I/σ(I) obs: 1.9 / % possible all: 80.8 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1OLS 解像度: 1.84→30 Å / Cor.coef. Fo:Fc: 0.967 / Cor.coef. Fo:Fc free: 0.948 / SU B: 4.229 / SU ML: 0.067 / 交差検証法: THROUGHOUT / ESU R: 0.107 / ESU R Free: 0.107 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 18.29 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.84→30 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



































 PDBj
PDBj






