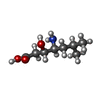
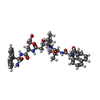
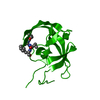
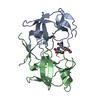
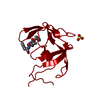
登録情報 データベース : PDB / ID : 1fivタイトル STRUCTURE OF AN INHIBITOR COMPLEX OF PROTEINASE FROM FELINE IMMUNODEFICIENCY VIRUS FIV PROTEASE FIV PROTEASE INHIBITOR ACE-ALN-VAL-STA-GLU-ALN-NH2 キーワード / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 手法 / 解像度 : 2 Å データ登録者 Wlodawer, A. / Gustchina, A. / Reshetnikova, L. / Lubkowski, J. / Zdanov, A. ジャーナル : Nat.Struct.Biol. / 年 : 1995タイトル : Structure of an inhibitor complex of the proteinase from feline immunodeficiency virus.著者 : Wlodawer, A. / Gustchina, A. / Reshetnikova, L. / Lubkowski, J. / Zdanov, A. / Hui, K.Y. / Angleton, E.L. / Farmerie, W.G. / Goodenow, M.M. / Bhatt, D. 履歴 登録 1995年5月4日 処理サイト 改定 1.0 1995年7月31日 Provider / タイプ 改定 1.1 2008年3月3日 Group 改定 1.2 2011年7月13日 Group Atomic model / Database references ... Atomic model / Database references / Derived calculations / Non-polymer description / Structure summary / Version format compliance 改定 1.3 2012年2月1日 Group 改定 1.4 2012年12月12日 Group 改定 1.5 2019年7月17日 Group Data collection / Derived calculations ... Data collection / Derived calculations / Other / Refinement description カテゴリ pdbx_database_status / pdbx_struct_special_symmetry ... pdbx_database_status / pdbx_struct_special_symmetry / software / struct_conn Item / _software.classification / _struct_conn.pdbx_leaving_atom_flag改定 1.6 2019年8月14日 Group / Refinement description / カテゴリ / Item
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Feline immunodeficiency virus (ネコ免疫不全ウイルス)
Feline immunodeficiency virus (ネコ免疫不全ウイルス) X線回折 / 解像度: 2 Å
X線回折 / 解像度: 2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nat.Struct.Biol. / 年: 1995
ジャーナル: Nat.Struct.Biol. / 年: 1995 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1fiv.cif.gz
1fiv.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1fiv.ent.gz
pdb1fiv.ent.gz PDB形式
PDB形式 1fiv.json.gz
1fiv.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1fiv_validation.pdf.gz
1fiv_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1fiv_full_validation.pdf.gz
1fiv_full_validation.pdf.gz 1fiv_validation.xml.gz
1fiv_validation.xml.gz 1fiv_validation.cif.gz
1fiv_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/fi/1fiv
https://data.pdbj.org/pub/pdb/validation_reports/fi/1fiv ftp://data.pdbj.org/pub/pdb/validation_reports/fi/1fiv
ftp://data.pdbj.org/pub/pdb/validation_reports/fi/1fiv リンク
リンク 集合体
集合体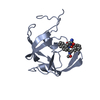
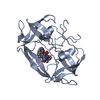
 要素
要素 Feline immunodeficiency virus (ネコ免疫不全ウイルス)
Feline immunodeficiency virus (ネコ免疫不全ウイルス)
 X線回折
X線回折 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj