+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1dy8 | ||||||
|---|---|---|---|---|---|---|---|
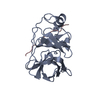
| タイトル | Inhibition of the Hepatitis C Virus NS3/4A Protease. The Crystal Structures of Two Protease-Inhibitor Complexes (inhibitor II) | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR / SERINE PROTEASE / PROTEASE INHIBITION / HYDROLASE-HYDROLASE INHIBITOR COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報RNA stabilization / DNA/DNA annealing activity / RNA strand annealing activity / RNA folding chaperone / hepacivirin / host cell mitochondrial membrane / host cell lipid droplet / symbiont-mediated transformation of host cell / symbiont-mediated suppression of host TRAF-mediated signal transduction / symbiont-mediated perturbation of host cell cycle G1/S transition checkpoint ...RNA stabilization / DNA/DNA annealing activity / RNA strand annealing activity / RNA folding chaperone / hepacivirin / host cell mitochondrial membrane / host cell lipid droplet / symbiont-mediated transformation of host cell / symbiont-mediated suppression of host TRAF-mediated signal transduction / symbiont-mediated perturbation of host cell cycle G1/S transition checkpoint / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT1 activity / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of MAVS activity / protein-DNA complex / nucleoside-triphosphate phosphatase / channel activity / viral nucleocapsid / monoatomic ion transmembrane transport / clathrin-dependent endocytosis of virus by host cell / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; システインプロテアーゼ / RNA helicase activity / host cell perinuclear region of cytoplasm / host cell endoplasmic reticulum membrane / RNA helicase / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / ribonucleoprotein complex / symbiont-mediated activation of host autophagy / serine-type endopeptidase activity / RNA-directed RNA polymerase / cysteine-type endopeptidase activity / viral RNA genome replication / RNA-directed RNA polymerase activity / fusion of virus membrane with host endosome membrane / viral envelope / virion attachment to host cell / host cell nucleus / host cell plasma membrane / virion membrane / structural molecule activity / ATP hydrolysis activity / proteolysis / DNA binding / RNA binding / zinc ion binding / ATP binding / membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  HEPATITIS C VIRUS (ウイルス) HEPATITIS C VIRUS (ウイルス) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.4 Å 分子置換 / 解像度: 2.4 Å | ||||||
 データ登録者 データ登録者 | Di Marco, S. / Rizzi, M. / Volpari, C. / Walsh, M. / Narjes, F. / Colarusso, S. / De Francesco, R. / Matassa, V.G. / Sollazzo, M. | ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2000 ジャーナル: J.Biol.Chem. / 年: 2000タイトル: Inhibition of the Hepatitis C Virus Ns3/4A Protease the Crystal Structures of Two Protease-Inhibitor Complexes 著者: Di Marco, S. / Rizzi, M. / Volpari, C. / Walsh, M. / Narjes, F. / Colarusso, S. / De Francesco, R. / Matassa, V.G. / Sollazzo, M. | ||||||
| 履歴 |
| ||||||
| Remark 700 | SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS AB AND BB IN EACH CHAIN ON SHEET RECORDS ... SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS AB AND BB IN EACH CHAIN ON SHEET RECORDS BELOW IS ACTUALLY AN 6-STRANDED BARREL THIS IS REPRESENTED BY A 7-STRANDED SHEET IN WHICH THE FIRST AND LAST STRANDS ARE IDENTICAL. |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1dy8.cif.gz 1dy8.cif.gz | 86.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1dy8.ent.gz pdb1dy8.ent.gz | 66.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1dy8.json.gz 1dy8.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1dy8_validation.pdf.gz 1dy8_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1dy8_full_validation.pdf.gz 1dy8_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  1dy8_validation.xml.gz 1dy8_validation.xml.gz | 22.2 KB | 表示 | |
| CIF形式データ |  1dy8_validation.cif.gz 1dy8_validation.cif.gz | 28.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/dy/1dy8 https://data.pdbj.org/pub/pdb/validation_reports/dy/1dy8 ftp://data.pdbj.org/pub/pdb/validation_reports/dy/1dy8 ftp://data.pdbj.org/pub/pdb/validation_reports/dy/1dy8 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
| ||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (0.61778, -0.78633, -0.00579), ベクター: |
- 要素
要素
| #1: タンパク質 | 分子量: 19749.553 Da / 分子数: 2 / 断片: PROTEASE / 由来タイプ: 組換発現 由来: (組換発現)  HEPATITIS C VIRUS (ISOLATE TAIWAN) (C型肝炎ウイルス) HEPATITIS C VIRUS (ISOLATE TAIWAN) (C型肝炎ウイルス)解説: CDNA OF HEPATITIS C VIRUS / 遺伝子: HCV / プラスミド: PT7-7 / 発現宿主:  参照: UniProt: Q81755, UniProt: P26662*PLUS, 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; システインプロテアーゼ #2: タンパク質・ペプチド | 分子量: 1686.097 Da / 分子数: 2 / 断片: RESIDUES 956-967 / Mutation: YES / 由来タイプ: 組換発現 由来: (組換発現)  HEPATITIS C VIRUS (ISOLATE TAIWAN) (C型肝炎ウイルス) HEPATITIS C VIRUS (ISOLATE TAIWAN) (C型肝炎ウイルス)解説: CDNA OF HEPATITIS C VIRUS / 遺伝子: HCV / プラスミド: PT7-7 / 発現宿主:  #3: 化合物 | #4: 水 | ChemComp-HOH / | Has protein modification | Y | 配列の詳細 | GENOME POLYPROTEIN, ID POLG_HCVJA_7, PROTEASE NS3 GENOME POLYPROTEIN, ID POLG_HCVJA_8, ...GENOME POLYPROTEI | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.37 Å3/Da / 溶媒含有率: 47.68 % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 5.1 詳細: THE NS3 PROTEIN (1MG/ML) WAS INCUBATE AT 4C WITH THE NS4A COFACTOR PEPTIDE, CONTAINING A SOLUBIZING LYSINE TAG AT ITS N- AND C-TERMINI(KGSVVIVGRIILSGRK), AT A MOLAR RATIO OF 1:2 AND ...詳細: THE NS3 PROTEIN (1MG/ML) WAS INCUBATE AT 4C WITH THE NS4A COFACTOR PEPTIDE, CONTAINING A SOLUBIZING LYSINE TAG AT ITS N- AND C-TERMINI(KGSVVIVGRIILSGRK), AT A MOLAR RATIO OF 1:2 AND CONCENTRATED TO 290 MICROMOLAR. NS3J/4A CRYSTAL WITH A MAXIMUM SIZE OF 0.6 X 0.3 X 0.2 MM**3, WERE OBTAINED BY BOTH HANGING- AND SITTING-DROP VAPOUR DIFFUSION METHODS AFTER TW WEEKS AT ROOM TEMPERATURE, WITH 3.4 M NACL, 10MM DTT, 0.1 M CITR BUFFER PH 5.1. THE TERNARY COMPLEX WITH INHIBITOR WAS PREPARED B ADDING 2.5 MM OF INIBITOR TO CRYSTALS THAT WERE STABILISED IN 4.5 M NACL, 10 MM DTT, 0.1 M CITRATE BUFFER, PH 5.1., VAPOR DIFFUSION, SITTING DROP, TEMPERATURE 277K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  EMBL/DESY, HAMBURG EMBL/DESY, HAMBURG  / ビームライン: X31 / 波長: 1.194 / ビームライン: X31 / 波長: 1.194 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1998年8月15日 / 詳細: BENT MIRROR |
| 放射 | モノクロメーター: SI(111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.194 Å / 相対比: 1 |
| 反射 | 解像度: 2.4→20 Å / Num. obs: 15872 / % possible obs: 99.8 % / Observed criterion σ(I): -3 / 冗長度: 3.5 % / Biso Wilson estimate: 40.68 Å2 / Rsym value: 0.137 / Net I/σ(I): 4.7 |
| 反射 シェル | 解像度: 2.4→2.53 Å / 冗長度: 3.4 % / Mean I/σ(I) obs: 1.7 / Rsym value: 0.425 / % possible all: 99.8 |
| 反射 | *PLUS Num. measured all: 55295 / Rmerge(I) obs: 0.137 |
| 反射 シェル | *PLUS % possible obs: 99.8 % / Rmerge(I) obs: 0.425 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1DY7 解像度: 2.4→20 Å / SU B: 4.58 / SU ML: 0.11 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.43 / ESU R Free: 0.34
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 45.4 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.4→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj