+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | RecBCD in complex with the phage protein gp5.9 | ||||||||||||
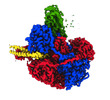
 マップデータ マップデータ | Final cryoEM map of the RecBCD-gp5.9 complex | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Homologous recombination / DNA repair / phage / Helicase / Nuclease / Inhibitor / Protein complex / Enzyme / DNA mimic / DNA BINDING PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報exodeoxyribonuclease V / exodeoxyribonuclease V activity / exodeoxyribonuclease V complex / clearance of foreign intracellular DNA / DNA 5'-3' helicase / DNA 3'-5' helicase / recombinational repair / single-stranded DNA helicase activity / 3'-5' DNA helicase activity / DNA helicase activity ...exodeoxyribonuclease V / exodeoxyribonuclease V activity / exodeoxyribonuclease V complex / clearance of foreign intracellular DNA / DNA 5'-3' helicase / DNA 3'-5' helicase / recombinational repair / single-stranded DNA helicase activity / 3'-5' DNA helicase activity / DNA helicase activity / isomerase activity / helicase activity / double-strand break repair via homologous recombination / response to radiation / 5'-3' DNA helicase activity / DNA recombination / DNA damage response / magnesium ion binding / ATP hydrolysis activity / DNA binding / ATP binding / cytosol 類似検索 - 分子機能 | ||||||||||||
| 生物種 |    Escherichia phage T7 (ファージ) Escherichia phage T7 (ファージ) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | ||||||||||||
 データ登録者 データ登録者 | Wilkinson M / Wilkinson OJ / Feyerherm C / Fletcher EE / Wigley DB / Dillingham MS | ||||||||||||
| 資金援助 |  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2022 ジャーナル: Elife / 年: 2022タイトル: Structures of RecBCD in complex with phage-encoded inhibitor proteins reveal distinctive strategies for evasion of a bacterial immunity hub. 著者: Martin Wilkinson / Oliver J Wilkinson / Connie Feyerherm / Emma E Fletcher / Dale B Wigley / Mark S Dillingham /  要旨: Following infection of bacterial cells, bacteriophage modulate double-stranded DNA break repair pathways to protect themselves from host immunity systems and prioritise their own recombinases. Here, ...Following infection of bacterial cells, bacteriophage modulate double-stranded DNA break repair pathways to protect themselves from host immunity systems and prioritise their own recombinases. Here, we present biochemical and structural analysis of two phage proteins, gp5.9 and Abc2, which target the DNA break resection complex RecBCD. These exemplify two contrasting mechanisms for control of DNA break repair in which the RecBCD complex is either inhibited or co-opted for the benefit of the invading phage. Gp5.9 completely inhibits RecBCD by preventing it from binding to DNA. The RecBCD-gp5.9 structure shows that gp5.9 acts by substrate mimicry, binding predominantly to the RecB arm domain and competing sterically for the DNA binding site. Gp5.9 adopts a parallel coiled-coil architecture that is unprecedented for a natural DNA mimic protein. In contrast, binding of Abc2 does not substantially affect the biochemical activities of isolated RecBCD. The RecBCD-Abc2 structure shows that Abc2 binds to the Chi-recognition domains of the RecC subunit in a position that might enable it to mediate the loading of phage recombinases onto its single-stranded DNA products. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15803.map.gz emd_15803.map.gz | 39.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15803-v30.xml emd-15803-v30.xml emd-15803.xml emd-15803.xml | 27.7 KB 27.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_15803.png emd_15803.png | 106.3 KB | ||
| Filedesc metadata |  emd-15803.cif.gz emd-15803.cif.gz | 8.8 KB | ||
| その他 |  emd_15803_additional_1.map.gz emd_15803_additional_1.map.gz emd_15803_half_map_1.map.gz emd_15803_half_map_1.map.gz emd_15803_half_map_2.map.gz emd_15803_half_map_2.map.gz | 39 MB 33 MB 33 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15803 http://ftp.pdbj.org/pub/emdb/structures/EMD-15803 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15803 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15803 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15803_validation.pdf.gz emd_15803_validation.pdf.gz | 940.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15803_full_validation.pdf.gz emd_15803_full_validation.pdf.gz | 940.1 KB | 表示 | |
| XML形式データ |  emd_15803_validation.xml.gz emd_15803_validation.xml.gz | 11.2 KB | 表示 | |
| CIF形式データ |  emd_15803_validation.cif.gz emd_15803_validation.cif.gz | 13 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15803 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15803 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15803 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15803 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15803.map.gz / 形式: CCP4 / 大きさ: 42.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15803.map.gz / 形式: CCP4 / 大きさ: 42.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Final cryoEM map of the RecBCD-gp5.9 complex | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||
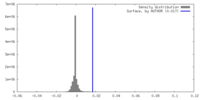
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Additional map from focus refinement around the phage...
| ファイル | emd_15803_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Additional map from focus refinement around the phage protein, used to help model building | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
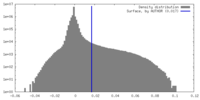
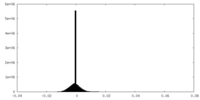
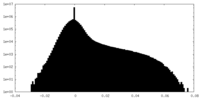
| 密度ヒストグラム |
-ハーフマップ: halfmap1
| ファイル | emd_15803_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | halfmap1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
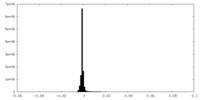
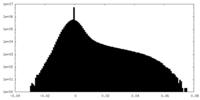
| 密度ヒストグラム |
-ハーフマップ: halfmap2
| ファイル | emd_15803_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | halfmap2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
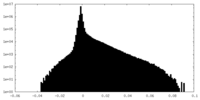
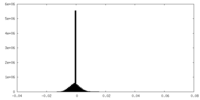
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex of gp5.9 bound to RecBCD
| 全体 | 名称: Complex of gp5.9 bound to RecBCD |
|---|---|
| 要素 |
|
-超分子 #1: Complex of gp5.9 bound to RecBCD
| 超分子 | 名称: Complex of gp5.9 bound to RecBCD / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 詳細: t7 gp5.9 purified separately and then mixed with RecBCD complex |
|---|
-超分子 #2: RecBCD enzyme subunit RecB, RecC and RecD
| 超分子 | 名称: RecBCD enzyme subunit RecB, RecC and RecD / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  |
-超分子 #3: Probable RecBCD inhibitor gp5.9
| 超分子 | 名称: Probable RecBCD inhibitor gp5.9 / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #4 |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage T7 (ファージ) Escherichia phage T7 (ファージ) |
-分子 #1: RecBCD enzyme subunit RecB
| 分子 | 名称: RecBCD enzyme subunit RecB / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: exodeoxyribonuclease V |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 134.110641 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSDVAETLDP LRLPLQGERL IEASAGTGKT FTIAALYLRL LLGLGGSAAF PRPLTVEELL VVTFTEAATA ELRGRIRSNI HELRIACLR ETTDNPLYER LLEEIDDKAQ AAQWLLLAER QMDEAAVFTI HGFCQRMLNL NAFESGMLFE QQLIEDESLL R YQACADFW ...文字列: MSDVAETLDP LRLPLQGERL IEASAGTGKT FTIAALYLRL LLGLGGSAAF PRPLTVEELL VVTFTEAATA ELRGRIRSNI HELRIACLR ETTDNPLYER LLEEIDDKAQ AAQWLLLAER QMDEAAVFTI HGFCQRMLNL NAFESGMLFE QQLIEDESLL R YQACADFW RRHCYPLPRE IAQVVFETWK GPQALLRDIN RYLQGEAPVI KAPPPDDETL ASRHAQIVAR IDTVKQQWRD AV GELDALI ESSGIDRRKF NRSNQAKWID KISAWAEEET NSYQLPESLE KFSQRFLEDR TKAGGETPRH PLFEAIDQLL AEP LSIRDL VITRALAEIR ETVAREKRRR GELGFDDMLS RLDSALRSES GEVLAAAIRT RFPVAMIDEF QDTDPQQYRI FRRI WHHQP ETALLLIGDP KQAIYAFRGA DIFTYMKARS EVHAHYTLDT NWRSAPGMVN SVNKLFSQTD DAFMFREIPF IPVKS AGKN QALRFVFKGE TQPAMKMWLM EGESCGVGDY QSTMAQVCAA QIRDWLQAGQ RGEALLMNGD DARPVRASDI SVLVRS RQE AAQVRDALTL LEIPSVYLSN RDSVFETLEA QEMLWLLQAV MTPERENTLR SALATSMMGL NALDIETLNN DEHAWDV VV EEFDGYRQIW RKRGVMPMLR ALMSARNIAE NLLATAGGER RLTDILHISE LLQEAGTQLE SEHALVRWLS QHILEPDS N ASSQQMRLES DKHLVQIVTI HKSKGLEYPL VWLPFITNFR VQEQAFYHDR HSFEAVLDLN AAPESVDLAE AERLAEDLR LLYVALTRSV WHCSLGVAPL VRRRGDKKGD TDVHQSALGR LLQKGEPQDA AGLRTCIEAL CDDDIAWQTA QTGDNQPWQV NDVSTAELN AKTLQRLPGD NWRVTSYSGL QQRGHGIAQD LMPRLDVDAA GVASVVEEPT LTPHQFPRGA SPGTFLHSLF E DLDFTQPV DPNWVREKLE LGGFESQWEP VLTEWITAVL QAPLNETGVS LSQLSARNKQ VEMEFYLPIS EPLIASQLDT LI RQFDPLS AGCPPLEFMQ VRGMLKGFID LVFRHEGRYY LLDYKSNWLG EDSSAYTQQA MAAAMQAHRY DLQYQLYTLA LHR YLRHRI ADYDYEHHFG GVIYLFLRGV DKEHPQQGIY TTRPNAGLIA LMDEMFAGMT LEEA UniProtKB: RecBCD enzyme subunit RecB |
-分子 #2: RecBCD enzyme subunit RecC
| 分子 | 名称: RecBCD enzyme subunit RecC / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO / EC番号: exodeoxyribonuclease V |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 128.974102 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MLRVYHSNRL DVLEALMEFI VERERLDDPF EPEMILVQST GMAQWLQMTL SQKFGIAANI DFPLPASFIW DMFVRVLPEI PKESAFNKQ SMSWKLMTLL PQLLEREDFT LLRHYLTDDS DKRKLFQLSS KAADLFDQYL VYRPDWLAQW ETGHLVEGLG E AQAWQAPL ...文字列: MLRVYHSNRL DVLEALMEFI VERERLDDPF EPEMILVQST GMAQWLQMTL SQKFGIAANI DFPLPASFIW DMFVRVLPEI PKESAFNKQ SMSWKLMTLL PQLLEREDFT LLRHYLTDDS DKRKLFQLSS KAADLFDQYL VYRPDWLAQW ETGHLVEGLG E AQAWQAPL WKALVEYTHQ LGQPRWHRAN LYQRFIETLE SATTCPPGLP SRVFICGISA LPPVYLQALQ ALGKHIEIHL LF TNPCRYY WGDIKDPAYL AKLLTRQRRH SFEDRELPLF RDSENAGQLF NSDGEQDVGN PLLASWGKLG RDYIYLLSDL ESS QELDAF VDVTPDNLLH NIQSDILELE NRAVAGVNIE EFSRSDNKRP LDPLDSSITF HVCHSPQREV EVLHDRLLAM LEED PTLTP RDIIVMVADI DSYSPFIQAV FGSAPADRYL PYAISDRRAR QSHPVLEAFI SLLSLPDSRF VSEDVLALLD VPVLA ARFD ITEEGLRYLR QWVNESGIRW GIDDDNVREL ELPATGQHTW RFGLTRMLLG YAMESAQGEW QSVLPYDESS GLIAEL VGH LASLLMQLNI WRRGLAQERP LEEWLPVCRD MLNAFFLPDA ETEAAMTLIE QQWQAIIAEG LGAQYGDAVP LSLLRDE LA QRLDQERISQ RFLAGPVNIC TLMPMRSIPF KVVCLLGMND GVYPRQLAPL GFDLMSQKPK RGDRSRRDDD RYLFLEAL I SAQQKLYISY IGRSIQDNSE RFPSVLVQEL IDYIGQSHYL PGDEALNCDE SEARVKAHLT CLHTRMPFDP QNYQPGERQ SYAREWLPAA SQAGKAHSEF VQPLPFTLPE TVPLETLQRF WAHPVRAFFQ MRLQVNFRTE DSEIPDTEPF ILEGLSRYQI NQQLLNALV EQDDAERLFR RFRAAGDLPY GAFGEIFWET QCQEMQQLAD RVIACRQPGQ SMEIDLACNG VQITGWLPQV Q PDGLLRWR PSLLSVAQGM QLWLEHLVYC ASGGNGESRL FLRKDGEWRF PPLAAEQALH YLSQLIEGYR EGMSAPLLVL PE SGGAWLK TCYDAQNDAM LDDDSTLQKA RTKFLQAYEG NMMVRGEGDD IWYQRLWRQL TPETMEAIVE QSQRFLLPLF RFN QS UniProtKB: RecBCD enzyme subunit RecC |
-分子 #3: RecBCD enzyme subunit RecD
| 分子 | 名称: RecBCD enzyme subunit RecD / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO / EC番号: exodeoxyribonuclease V |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 66.990367 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKLQKQLLEA VEHKQLRPLD VQFALTVAGD EHPAVTLAAA LLSHDAGEGH VCLPLSRLEN NEASHPLLAT CVSEIGELQN WEECLLASQ AVSRGDEPTP MILCGDRLYL NRMWCNERTV ARFFNEVNHA IEVDEALLAQ TLDKLFPVSD EINWQKVAAA V ALTRRISV ...文字列: MKLQKQLLEA VEHKQLRPLD VQFALTVAGD EHPAVTLAAA LLSHDAGEGH VCLPLSRLEN NEASHPLLAT CVSEIGELQN WEECLLASQ AVSRGDEPTP MILCGDRLYL NRMWCNERTV ARFFNEVNHA IEVDEALLAQ TLDKLFPVSD EINWQKVAAA V ALTRRISV ISGGPGTGKT TTVAKLLAAL IQMADGERCR IRLAAPTGKA AARLTESLGK ALRQLPLTDE QKKRIPEDAS TL HRLLGAQ PGSQRLRHHA GNPLHLDVLV VDEASMIDLP MMSRLIDALP DHARVIFLGD RDQLASVEAG AVLGDICAYA NAG FTAERA RQLSRLTGTH VPAGTGTEAA SLRDSLCLLQ KSYRFGSDSG IGQLAAAINR GDKTAVKTVF QQDFTDIEKR LLQS GEDYI AMLEEALAGY GRYLDLLQAR AEPDLIIQAF NEYQLLCALR EGPFGVAGLN ERIEQFMQQK RKIHRHPHSR WYEGR PVMI ARNDSALGLF NGDIGIALDR GQGTRVWFAM PDGNIKSVQP SRLPEHETTW AMTVHKSQGS EFDHAALILP SQRTPV VTR ELVYTAVTRA RRRLSLYADE RILSAAIATR TERRSGLAAL FSSRE UniProtKB: RecBCD enzyme subunit RecD |
-分子 #4: Probable RecBCD inhibitor gp5.9
| 分子 | 名称: Probable RecBCD inhibitor gp5.9 / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia phage T7 (ファージ) Escherichia phage T7 (ファージ) |
| 分子量 | 理論値: 6.049601 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MSRDLVTIPR DVWNDIQGYI DSLERENDSL KNQLMEADEY VAELEEKLNG TS UniProtKB: Probable RecBCD inhibitor gp5.9 |
-分子 #5: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 5 / コピー数: 1 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.1 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: GRAPHENE OXIDE 詳細: Mixture of graphene oxide with 0.3 mM DDM detergent applied directly to grids twice before application of sample | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / 装置: FEI VITROBOT MARK IV / 詳細: 1.5s blot time. | |||||||||||||||
| 詳細 | RecBCD mixed with T7 gp5.9 protein prior to making grids |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 5064 / 平均露光時間: 4.3 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)