+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | PAPP-A dimer in complex with a dimer of the inhibitor STC2 | |||||||||
 マップデータ マップデータ | Primary, sharpened map of PAPP-A dimer with its endogenous inhibitor STC2 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Metzincin metalloprotease Inhibitor complex / HYDROLASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of hormone biosynthetic process / regulation of store-operated calcium entry / response to vitamin D / negative regulation of multicellular organism growth / decidualization / endoplasmic reticulum unfolded protein response / embryo implantation / Post-translational protein phosphorylation / hormone activity / response to peptide hormone ...regulation of hormone biosynthetic process / regulation of store-operated calcium entry / response to vitamin D / negative regulation of multicellular organism growth / decidualization / endoplasmic reticulum unfolded protein response / embryo implantation / Post-translational protein phosphorylation / hormone activity / response to peptide hormone / intracellular calcium ion homeostasis / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / cellular response to hypoxia / response to oxidative stress / endoplasmic reticulum lumen / negative regulation of gene expression / heme binding / perinuclear region of cytoplasm / Golgi apparatus / enzyme binding / endoplasmic reticulum / protein homodimerization activity / extracellular space 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
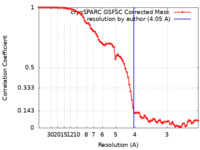
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.05 Å | |||||||||
 データ登録者 データ登録者 | Kobbero SD / Oxvig C / Gajhede M / Boesen T | |||||||||
| 資金援助 |  デンマーク, 1件 デンマーク, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structure of the proteolytic enzyme PAPP-A with the endogenous inhibitor stanniocalcin-2 reveals its inhibitory mechanism. 著者: Sara Dam Kobberø / Michael Gajhede / Osman Asghar Mirza / Søren Kløverpris / Troels Rønn Kjær / Jakob Hauge Mikkelsen / Thomas Boesen / Claus Oxvig /  要旨: The metzincin metalloproteinase PAPP-A plays a key role in the regulation of insulin-like growth factor (IGF) signaling by specific cleavage of inhibitory IGF binding proteins (IGFBPs). Using single- ...The metzincin metalloproteinase PAPP-A plays a key role in the regulation of insulin-like growth factor (IGF) signaling by specific cleavage of inhibitory IGF binding proteins (IGFBPs). Using single-particle cryo-electron microscopy (cryo-EM), we here report the structure of PAPP-A in complex with its endogenous inhibitor, stanniocalcin-2 (STC2), neither of which have been reported before. The highest resolution (3.1 Å) was obtained for the STC2 subunit and the N-terminal approximately 1000 residues of the PAPP-A subunit. The 500 kDa 2:2 PAPP-A·STC2 complex is a flexible multidomain ensemble with numerous interdomain contacts. In particular, a specific disulfide bond between the subunits of STC2 and PAPP-A prevents dissociation, and interactions between STC2 and a module located in the very C-terminal end of the PAPP-A subunit prevent binding of its main substrate, IGFBP-4. While devoid of activity towards IGFBP-4, the active site cleft of the catalytic domain is accessible in the inhibited PAPP-A·STC2 complex, as shown by its ability to hydrolyze a synthetic peptide derived from IGFBP-4. Relevant to multiple human pathologies, this unusual mechanism of proteolytic inhibition may support the development of specific pharmaceutical agents, by which IGF signaling can be indirectly modulated. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15217.map.gz emd_15217.map.gz | 59.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15217-v30.xml emd-15217-v30.xml emd-15217.xml emd-15217.xml | 19.8 KB 19.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15217_fsc.xml emd_15217_fsc.xml | 8.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15217.png emd_15217.png | 72 KB | ||
| Filedesc metadata |  emd-15217.cif.gz emd-15217.cif.gz | 6.2 KB | ||
| その他 |  emd_15217_additional_1.map.gz emd_15217_additional_1.map.gz emd_15217_half_map_1.map.gz emd_15217_half_map_1.map.gz emd_15217_half_map_2.map.gz emd_15217_half_map_2.map.gz | 31.6 MB 59.3 MB 59.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15217 http://ftp.pdbj.org/pub/emdb/structures/EMD-15217 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15217 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15217 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15217_validation.pdf.gz emd_15217_validation.pdf.gz | 850.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15217_full_validation.pdf.gz emd_15217_full_validation.pdf.gz | 850.1 KB | 表示 | |
| XML形式データ |  emd_15217_validation.xml.gz emd_15217_validation.xml.gz | 16.2 KB | 表示 | |
| CIF形式データ |  emd_15217_validation.cif.gz emd_15217_validation.cif.gz | 20.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15217 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15217 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15217 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15217 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15217.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15217.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
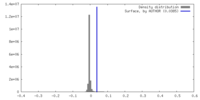
| 注釈 | Primary, sharpened map of PAPP-A dimer with its endogenous inhibitor STC2 | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.18594 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Raw map of PAPP-A dimer with its endogenous inhibitor STC2
| ファイル | emd_15217_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
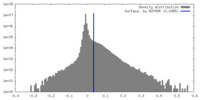
| 注釈 | Raw map of PAPP-A dimer with its endogenous inhibitor STC2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map A from the raw map
| ファイル | emd_15217_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
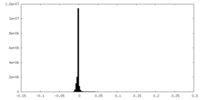
| 注釈 | Half map A from the raw map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map B from the raw map
| ファイル | emd_15217_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
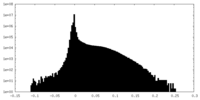
| 注釈 | Half map B from the raw map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : PAPP-A dimer in complex with its endogenous inhibitor STC2 dimer
| 全体 | 名称: PAPP-A dimer in complex with its endogenous inhibitor STC2 dimer |
|---|---|
| 要素 |
|
-超分子 #1: PAPP-A dimer in complex with its endogenous inhibitor STC2 dimer
| 超分子 | 名称: PAPP-A dimer in complex with its endogenous inhibitor STC2 dimer タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Inhibited proteolytic complex generated by harvest of serum media, purifying on a nickel column followed by negative affinity purification and size-exclusion chromatography. |
|---|---|
| 分子量 | 理論値: 400 KDa |
-超分子 #2: PAPP-A
| 超分子 | 名称: PAPP-A / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 / 詳細: Homodimer Pregnancy-associated plasma protein A |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular |
-超分子 #3: Stanniocalcin-2
| 超分子 | 名称: Stanniocalcin-2 / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 / 詳細: Homodimer |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular Homo sapiens (ヒト) / 組織: ubiquitous / 細胞中の位置: extracellular |
-分子 #1: PAPP-A
| 分子 | 名称: PAPP-A / タイプ: protein_or_peptide / ID: 1 詳細: A heterotetrameric complex between the protease PAPP-A dimer and its endogenous inhibitor STC2 光学異性体: LEVO / EC番号: pappalysin-1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: EARGATEEPS PPSRALYFSG RGEQLRLRAD LELPRDAFT LQVWLRAEGG QRSPAVITGL YDKCSYISRD RGWVVGIHTI SDQDNKDPRY FFSLKTDRAR QVTTINAHR SYLPGQWVYL AATYDGQFMK LYVNGAQVAT SGEQVGGIFS PLTQKCKVLM L GGSALNHN ...文字列: EARGATEEPS PPSRALYFSG RGEQLRLRAD LELPRDAFT LQVWLRAEGG QRSPAVITGL YDKCSYISRD RGWVVGIHTI SDQDNKDPRY FFSLKTDRAR QVTTINAHR SYLPGQWVYL AATYDGQFMK LYVNGAQVAT SGEQVGGIFS PLTQKCKVLM L GGSALNHN YRGYIEHFSL WKVARTQREI LSDMETHGAH TALPQLLLQE NWDNVKHAWS PM KDGSSPK VEFSNAHGFL LDTSLEPPLC GQTLCDNTEV IASYNQLSSF RQPKVVRYRV VNL YEDDHK NPTVTREQVD FQHHQLAEAF KQYNISWELD VLEVSNSSLR RRLILANCDI SKIG DENCD PECNHTLTGH DGGDCRHLRH PAFVKKQHNG VCDMDCNYER FNFDGGECCD PEITN VTQT CFDPDSPHRA YLDVNELKNI LKLDGSTHLN IFFAKSSEEE LAGVATWPWD KEALMH LGG IVLNPSFYGM PGHTHTMIHE IGHSLGLYHV FRGISEIQSC SDPCMETEPS FETGDLC ND TNPAPKHKSC GDPGPGNDTC GFHSFFNTPY NNFMSYADDD CTDSFTPNQV ARMHCYLD L VYQGWQPSRK PAPVALAPQV LGHTTDSVTL EWFPPIDGHF FERELGSACH LCLEGRILV QYASNASSPM PCSPSGHWSP REAEGHPDVE QPCKSSVRTW SPNSAVNPHT VPPACPEPQG CYLELEFLY PLVPESLTIW VTFVSTDWDS SGAVNDIKLL AVSGKNISLG PQNVFCDVPL T IRLWDVGE EVYGIQIYTL DEHLEIDAAM LTSTADTPLC LQCKPLKYKV VRDPPLQMDV AS ILHLNRK FVDMDLNLGS VYQYWVITIS GTEESEPSPA VTYIHGSGYC GDGIIQKDQG EQC DDMNKI NGDGCSLFCR QEVSFNCIDE PSRCYFHDGD GVCEEFEQKT SIKDCGVYTP QGFL DQWAS NASVSHQDQQ CPGWVIIGQP AASQVCRTKV IDLSEGISQH AWYPCTISYP YSQLA QTTF WLRAYFSQPM VAAAVIVHLV TDGTYYGDQK QETISVQLLD TKDQSHDLGL HVLSCR NNP LIIPVVHDLS QPFYHSQAVR VSFSSPLVAI SGVALRSFDN FDPVTLSSCQ RGETYSP AE QSCVHFACEK TDCPELAVEN ASLNCSSSDR YHGAQCTVSC RTGYVLQIRR DDELIKSQ T GPSVTVTCTE GKWNKQVACE PVDCSIPDHH QVYAASFSCP EGTTFGSQCS FQCRHPAQL KGNNSLLTCM EDGLWSFPEA LCELMCLAPP PVPNADLQTA RCRENKHKVG SFCKYKCKPG YHVPGSSRK SKKRAFKTQC TQDGSWQEGA CVPVTCDPPP PKFHGLYQCT NGFQFNSECR I KCEDSDAS QGLGSNVIHC RKDGTWNGSF HVCQEMQGQC SVPNELNSNL KLQCPDGYAI GS ECATSCL DHNSESIILP MNVTVRDIPH WLNPTRVERV VCTAGLKWYP HPALIHCVKG CEP FMGDNY CDAINNRAFC NYDGGDCCTS TVKTKKVTPF PMSCDLQGDC ACRDPQAQEH SRKD LRGYS HG GENBANK: GENBANK: Q13219 |
-分子 #2: STC2
| 分子 | 名称: STC2 / タイプ: protein_or_peptide / ID: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 細胞: Extracellular Homo sapiens (ヒト) / 細胞: Extracellular |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MCAERLGQFM TLALVLATFD PARGTDATNP PEGPQDRSSQ QKGRLSLQNT AEIQHCLVNA GDVGCGVFE CFENNSCEIR GLHGICMTFL HNAGKFDAQG KSFIKDALKC KAHALRHRFG C ISRKCPAI REMVSQLQRE CYLKHDLCAA AQENTRVIVE MIHFKDLLLH ...文字列: MCAERLGQFM TLALVLATFD PARGTDATNP PEGPQDRSSQ QKGRLSLQNT AEIQHCLVNA GDVGCGVFE CFENNSCEIR GLHGICMTFL HNAGKFDAQG KSFIKDALKC KAHALRHRFG C ISRKCPAI REMVSQLQRE CYLKHDLCAA AQENTRVIVE MIHFKDLLLH EPYVDLVNLL LT CGEEVKE AITHSVQVQC EQNWGSLCSI LSFCTSAIQK PPTAPPERQP QVDRTKLSRA HHG EAGHHL PEPSSRETGR GAKGERGSKS HPNAHARGRV GGLGAQGPSG SSEWEDEQSE YSDI RR UniProtKB: Stanniocalcin-2 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.6 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 詳細: HEPES buffer |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 59.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 0.6 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: RIGID BODY FIT |
|---|
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)