+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human GYS1-GYG1 complex activated state bound to glucose-6-phosphate, uridine diphosphate, and glucose | |||||||||
 マップデータ マップデータ | Locally filtered map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Glycogen / Complex / Phosphorylation / TRANSFERASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報glycogen synthase activity, transferring glucose-1-phosphate / Glycogen storage disease type XV (GYG1) / Glycogen storage disease type 0 (muscle GYS1) / glycogen(starch) synthase / Glycogen storage disease type II (GAA) / glycogenin glucosyltransferase / glycogenin glucosyltransferase activity / : / alpha-1,4-glucan glucosyltransferase (UDP-glucose donor) activity / D-glucose binding ...glycogen synthase activity, transferring glucose-1-phosphate / Glycogen storage disease type XV (GYG1) / Glycogen storage disease type 0 (muscle GYS1) / glycogen(starch) synthase / Glycogen storage disease type II (GAA) / glycogenin glucosyltransferase / glycogenin glucosyltransferase activity / : / alpha-1,4-glucan glucosyltransferase (UDP-glucose donor) activity / D-glucose binding / glycogen biosynthetic process / Glycogen breakdown (glycogenolysis) / glycosyltransferase activity / inclusion body / Myoclonic epilepsy of Lafora / Glycogen synthesis / lysosomal lumen / heart development / manganese ion binding / secretory granule lumen / ficolin-1-rich granule lumen / Neutrophil degranulation / protein homodimerization activity / extracellular region / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
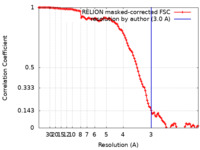
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | McCorvie TJ / Shrestha L | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2022 ジャーナル: Nat Struct Mol Biol / 年: 2022タイトル: Molecular basis for the regulation of human glycogen synthase by phosphorylation and glucose-6-phosphate. 著者: Thomas J McCorvie / Paula M Loria / Meihua Tu / Seungil Han / Leela Shrestha / D Sean Froese / Igor M Ferreira / Allison P Berg / Wyatt W Yue /    要旨: Glycogen synthase (GYS1) is the central enzyme in muscle glycogen biosynthesis. GYS1 activity is inhibited by phosphorylation of its amino (N) and carboxyl (C) termini, which is relieved by ...Glycogen synthase (GYS1) is the central enzyme in muscle glycogen biosynthesis. GYS1 activity is inhibited by phosphorylation of its amino (N) and carboxyl (C) termini, which is relieved by allosteric activation of glucose-6-phosphate (Glc6P). We present cryo-EM structures at 3.0-4.0 Å resolution of phosphorylated human GYS1, in complex with a minimal interacting region of glycogenin, in the inhibited, activated and catalytically competent states. Phosphorylations of specific terminal residues are sensed by different arginine clusters, locking the GYS1 tetramer in an inhibited state via intersubunit interactions. The Glc6P activator promotes conformational change by disrupting these interactions and increases the flexibility of GYS1, such that it is poised to adopt a catalytically competent state when the sugar donor UDP-glucose (UDP-glc) binds. We also identify an inhibited-like conformation that has not transitioned into the activated state, in which the locking interaction of phosphorylation with the arginine cluster impedes subsequent conformational changes due to Glc6P binding. Our results address longstanding questions regarding the mechanism of human GYS1 regulation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_13753.map.gz emd_13753.map.gz | 76 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-13753-v30.xml emd-13753-v30.xml emd-13753.xml emd-13753.xml | 27.6 KB 27.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_13753_fsc.xml emd_13753_fsc.xml | 11.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_13753.png emd_13753.png | 193 KB | ||
| マスクデータ |  emd_13753_msk_1.map emd_13753_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-13753.cif.gz emd-13753.cif.gz | 7.2 KB | ||
| その他 |  emd_13753_additional_1.map.gz emd_13753_additional_1.map.gz emd_13753_additional_2.map.gz emd_13753_additional_2.map.gz emd_13753_half_map_1.map.gz emd_13753_half_map_1.map.gz emd_13753_half_map_2.map.gz emd_13753_half_map_2.map.gz | 8.8 MB 96.7 MB 96.8 MB 97 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-13753 http://ftp.pdbj.org/pub/emdb/structures/EMD-13753 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13753 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13753 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_13753_validation.pdf.gz emd_13753_validation.pdf.gz | 830.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_13753_full_validation.pdf.gz emd_13753_full_validation.pdf.gz | 830.3 KB | 表示 | |
| XML形式データ |  emd_13753_validation.xml.gz emd_13753_validation.xml.gz | 18.6 KB | 表示 | |
| CIF形式データ |  emd_13753_validation.cif.gz emd_13753_validation.cif.gz | 24.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13753 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13753 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13753 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13753 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_13753.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_13753.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Locally filtered map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_13753_msk_1.map emd_13753_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
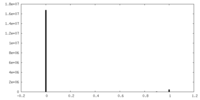
| 密度ヒストグラム |
-追加マップ: Sharpened map
| ファイル | emd_13753_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
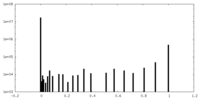
| 密度ヒストグラム |
-追加マップ: Non-sharpened map
| ファイル | emd_13753_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Non-sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half-map 1
| ファイル | emd_13753_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
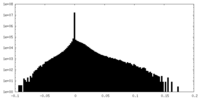
| 密度ヒストグラム |
-ハーフマップ: Half-map 2
| ファイル | emd_13753_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
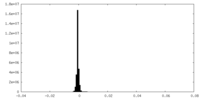
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Ternary complex of phosphorylated full-length human glycogen synt...
| 全体 | 名称: Ternary complex of phosphorylated full-length human glycogen synthase 1 in complex with minimum region of human glycogenin-1 |
|---|---|
| 要素 |
|
-超分子 #1: Ternary complex of phosphorylated full-length human glycogen synt...
| 超分子 | 名称: Ternary complex of phosphorylated full-length human glycogen synthase 1 in complex with minimum region of human glycogenin-1 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: muscle Homo sapiens (ヒト) / 組織: muscle |
| 分子量 | 理論値: 350 KDa |
-分子 #1: Glycogen [starch] synthase, muscle
| 分子 | 名称: Glycogen [starch] synthase, muscle / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: glycogen(starch) synthase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: muscle Homo sapiens (ヒト) / 組織: muscle |
| 分子量 | 理論値: 83.88543 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPLNRTLSMS SLPGLEDWED EFDLENAVLF EVAWEVANKV GGIYTVLQTK AKVTGDEWGD NYFLVGPYTE QGVRTQVELL EAPTPALKR TLDSMNSKGC KVYFGRWLIE GGPLVVLLDV GASAWALERW KGELWDTCNI GVPWYDREAN DAVLFGFLTT W FLGEFLAQ ...文字列: MPLNRTLSMS SLPGLEDWED EFDLENAVLF EVAWEVANKV GGIYTVLQTK AKVTGDEWGD NYFLVGPYTE QGVRTQVELL EAPTPALKR TLDSMNSKGC KVYFGRWLIE GGPLVVLLDV GASAWALERW KGELWDTCNI GVPWYDREAN DAVLFGFLTT W FLGEFLAQ SEEKPHVVAH FHEWLAGVGL CLCRARRLPV ATIFTTHATL LGRYLCAGAV DFYNNLENFN VDKEAGERQI YH RYCMERA AAHCAHVFTT VSQITAIEAQ HLLKRKPDIV TPNGLNVKKF SAMHEFQNLH AQSKARIQEF VRGHFYGHLD FNL DKTLYF FIAGRYEFSN KGADVFLEAL ARLNYLLRVN GSEQTVVAFF IMPARTNNFN VETLKGQAVR KQLWDTANTV KEKF GRKLY ESLLVGSLPD MNKMLDKEDF TMMKRAIFAT QRQSFPPVCT HNMLDDSSDP ILTTIRRIGL FNSSADRVKV IFHPE FLSS TSPLLPVDYE EFVRGCHLGV FPSYYEPWGY TPAECTVMGI PSISTNLSGF GCFMEEHIAD PSAYGIYILD RRFRSL DDS CSQLTSFLYS FCQQSRRQRI IQRNRTERLS DLLDWKYLGR YYMSARHMAL SKAFPEHFTY EPNEADAAQG YRYPRPA SV PPSPSLSRHS SPHQSEDEED PRNGPLEEDG ERYDEDEEAA KDRRNIRAPE WPRRASCTSS TSGSKRNSVD TATSSSLS T PSEPLSPTSS LGEERN UniProtKB: Glycogen [starch] synthase, muscle |
-分子 #2: Glycogenin-1
| 分子 | 名称: Glycogenin-1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO / EC番号: glycogenin glucosyltransferase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: muscle Homo sapiens (ヒト) / 組織: muscle |
| 分子量 | 理論値: 39.422621 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTDQAFVTLT TNDAYAKGAL VLGSSLKQHR TTRRLVVLAT PQVSDSMRKV LETVFDEVIM VDVLDSGDSA HLTLMKRPEL GVTLTKLHC WSLTQYSKCV FMDADTLVLA NIDDLFDREE LSAAPDPGWP DCFNSGVFVY QPSVETYNQL LHLASEQGSF D GGDQGILN ...文字列: MTDQAFVTLT TNDAYAKGAL VLGSSLKQHR TTRRLVVLAT PQVSDSMRKV LETVFDEVIM VDVLDSGDSA HLTLMKRPEL GVTLTKLHC WSLTQYSKCV FMDADTLVLA NIDDLFDREE LSAAPDPGWP DCFNSGVFVY QPSVETYNQL LHLASEQGSF D GGDQGILN TFFSSWATTD IRKHLPFIYN LSSISIYSYL PAFKVFGASA KVVHFLGRVK PWNYTYDPKT KSVKSEAHDP NM THPEFLI LWWNIFTTNV LPLLQQFGLV KDTCSYVNVL SDLVYTLAFS CGFCRKEDVS GAISHLSLGE IPAMAQPFVS SEE RKERWE QGQADYMGAD SFDNIKRKLD TYLQ UniProtKB: Glycogenin-1 |
-分子 #3: 6-O-phosphono-alpha-D-glucopyranose
| 分子 | 名称: 6-O-phosphono-alpha-D-glucopyranose / タイプ: ligand / ID: 3 / コピー数: 4 / 式: G6P |
|---|---|
| 分子量 | 理論値: 260.136 Da |
| Chemical component information |  ChemComp-G6P: |
-分子 #4: URIDINE-5'-DIPHOSPHATE
| 分子 | 名称: URIDINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 4 / コピー数: 4 / 式: UDP |
|---|---|
| 分子量 | 理論値: 404.161 Da |
| Chemical component information |  ChemComp-UDP: |
-分子 #5: alpha-D-glucopyranose
| 分子 | 名称: alpha-D-glucopyranose / タイプ: ligand / ID: 5 / コピー数: 4 / 式: GLC |
|---|---|
| 分子量 | 理論値: 180.156 Da |
| Chemical component information | 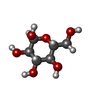 ChemComp-GLC: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: 25 mM HEPES, pH 7.5, 200 mM NaCl, 2.0 mM TCEP, 0.05% (v/v) tween-20 filtered sterilised with 5 mM glucose-6-phosphate and 5 mM UDP-glucose | |||||||||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 支持フィルム - Film thickness: 12 / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 30 sec. | |||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm 最大 デフォーカス(公称値): 2.3000000000000003 µm 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||
|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 温度因子: 41.65 / 当てはまり具合の基準: correlation coefficient | ||||||
| 得られたモデル |  PDB-7q13: |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)