[English] 日本語
 Yorodumi
Yorodumi- EMDB-12794: Cryo-EM structure of a twisted-dimer transthyretin amyloid fibril... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: EMDB / ID: EMD-12794 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Cryo-EM structure of a twisted-dimer transthyretin amyloid fibril from vitreous body of the eye | |||||||||
 Map data Map data | ||||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | AMYLOID FIBRIL / TRANSTHYRETIN / MISFOLDING / PROTEIN FIBRIL / ATTR AMYLOIDOSIS / V30M VARIANT / EX VIVO / VITREOUS BODY | |||||||||
| Function / homology |  Function and homology information Function and homology informationDefective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / hormone binding / Non-integrin membrane-ECM interactions / molecular sequestering activity / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport ...Defective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / hormone binding / Non-integrin membrane-ECM interactions / molecular sequestering activity / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation / protein-containing complex binding / protein-containing complex / extracellular space / extracellular exosome / extracellular region / identical protein binding Similarity search - Function | |||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||
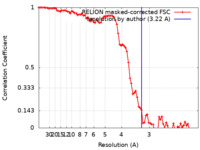
| Method | helical reconstruction / cryo EM / Resolution: 3.22 Å | |||||||||
 Authors Authors | Iakovleva I / Sauer-Eriksson AE | |||||||||
| Funding support |  Sweden, 1 items Sweden, 1 items
| |||||||||
 Citation Citation |  Journal: Nat Commun / Year: 2021 Journal: Nat Commun / Year: 2021Title: Structural basis for transthyretin amyloid formation in vitreous body of the eye. Authors: Irina Iakovleva / Michael Hall / Melanie Oelker / Linda Sandblad / Intissar Anan / A Elisabeth Sauer-Eriksson /  Abstract: Amyloid transthyretin (ATTR) amyloidosis is characterized by the abnormal accumulation of ATTR fibrils in multiple organs. However, the structure of ATTR fibrils from the eye is poorly understood. ...Amyloid transthyretin (ATTR) amyloidosis is characterized by the abnormal accumulation of ATTR fibrils in multiple organs. However, the structure of ATTR fibrils from the eye is poorly understood. Here, we used cryo-EM to structurally characterize vitreous body ATTR fibrils. These structures were distinct from previously characterized heart fibrils, even though both have the same mutation and type A pathology. Differences were observed at several structural levels: in both the number and arrangement of protofilaments, and the conformation of the protein fibril in each layer of protofilaments. Thus, our results show that ATTR protein structure and its assembly into protofilaments in the type A fibrils can vary between patients carrying the same mutation. By analyzing and matching the interfaces between the amino acids in the ATTR fibril with those in the natively folded TTR, we are able to propose a mechanism for the structural conversion of TTR into a fibrillar form. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | EM map:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| Supplemental images |
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_12794.map.gz emd_12794.map.gz | 13 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-12794-v30.xml emd-12794-v30.xml emd-12794.xml emd-12794.xml | 10.1 KB 10.1 KB | Display Display |  EMDB header EMDB header |
| FSC (resolution estimation) |  emd_12794_fsc.xml emd_12794_fsc.xml | 7.9 KB | Display |  FSC data file FSC data file |
| Images |  emd_12794.png emd_12794.png | 117.9 KB | ||
| Filedesc metadata |  emd-12794.cif.gz emd-12794.cif.gz | 4.9 KB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12794 http://ftp.pdbj.org/pub/emdb/structures/EMD-12794 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12794 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12794 | HTTPS FTP |
-Validation report
| Summary document |  emd_12794_validation.pdf.gz emd_12794_validation.pdf.gz | 549.7 KB | Display |  EMDB validaton report EMDB validaton report |
|---|---|---|---|---|
| Full document |  emd_12794_full_validation.pdf.gz emd_12794_full_validation.pdf.gz | 549.2 KB | Display | |
| Data in XML |  emd_12794_validation.xml.gz emd_12794_validation.xml.gz | 10.4 KB | Display | |
| Data in CIF |  emd_12794_validation.cif.gz emd_12794_validation.cif.gz | 13.4 KB | Display | |
| Arichive directory |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12794 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12794 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12794 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12794 | HTTPS FTP |
-Related structure data
| Related structure data |  7ob4MC M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| Related items in Molecule of the Month |
- Map
Map
| File |  Download / File: emd_12794.map.gz / Format: CCP4 / Size: 40.6 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_12794.map.gz / Format: CCP4 / Size: 40.6 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 1.041 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
CCP4 map header:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-Supplemental data
- Sample components
Sample components
-Entire : Transthyretin derived amyloid fibril (V30M) from vitreous body
| Entire | Name: Transthyretin derived amyloid fibril (V30M) from vitreous body |
|---|---|
| Components |
|
-Supramolecule #1: Transthyretin derived amyloid fibril (V30M) from vitreous body
| Supramolecule | Name: Transthyretin derived amyloid fibril (V30M) from vitreous body type: tissue / ID: 1 / Parent: 0 / Macromolecule list: all |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) / Organ: Vitreous body of the eye Homo sapiens (human) / Organ: Vitreous body of the eye |
-Macromolecule #1: Transthyretin
| Macromolecule | Name: Transthyretin / type: protein_or_peptide / ID: 1 / Number of copies: 14 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 13.809426 KDa |
| Sequence | String: GPTGTGESKC PLMVKVLDAV RGSPAINVAM HVFRKAADDT WEPFASGKTS ESGELHGLTT EEEFVEGIYK VEIDTKSYWK ALGISPFHE HAEVVFTAND SGPRRYTIAA LLSPYSYSTT AVVTNPKE UniProtKB: Transthyretin |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | helical reconstruction |
| Aggregation state | helical array |
- Sample preparation
Sample preparation
| Buffer | pH: 7.4 |
|---|---|
| Vitrification | Cryogen name: ETHANE / Instrument: FEI VITROBOT MARK IV |
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Image recording | Film or detector model: GATAN K2 SUMMIT (4k x 4k) / Average electron dose: 28.4 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
 Movie
Movie Controller
Controller














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)