+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11606 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM map of the large glutamate dehydrogenase composed of 180 kDa subunits from Mycobacterium smegmatis (open conformation) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | large glutamate dehydrogenase Mycobacterium metabolism / OXIDOREDUCTASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Mycolicibacterium smegmatis MC2 155 (バクテリア) / Mycolicibacterium smegmatis MC2 155 (バクテリア) /  Mycolicibacterium smegmatis (strain ATCC 700084 / mc(2)155) (バクテリア) Mycolicibacterium smegmatis (strain ATCC 700084 / mc(2)155) (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.19 Å | |||||||||
 データ登録者 データ登録者 | Lazaro M / Melero R | |||||||||
| 資金援助 |  スペイン, 1件 スペイン, 1件
| |||||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2021 ジャーナル: Commun Biol / 年: 2021タイトル: 3D architecture and structural flexibility revealed in the subfamily of large glutamate dehydrogenases by a mycobacterial enzyme. 著者: Melisa Lázaro / Roberto Melero / Charlotte Huet / Jorge P López-Alonso / Sandra Delgado / Alexandra Dodu / Eduardo M Bruch / Luciano A Abriata / Pedro M Alzari / Mikel Valle / María-Natalia Lisa /     要旨: Glutamate dehydrogenases (GDHs) are widespread metabolic enzymes that play key roles in nitrogen homeostasis. Large glutamate dehydrogenases composed of 180 kDa subunits (L-GDHs) contain long N- ...Glutamate dehydrogenases (GDHs) are widespread metabolic enzymes that play key roles in nitrogen homeostasis. Large glutamate dehydrogenases composed of 180 kDa subunits (L-GDHs) contain long N- and C-terminal segments flanking the catalytic core. Despite the relevance of L-GDHs in bacterial physiology, the lack of structural data for these enzymes has limited the progress of functional studies. Here we show that the mycobacterial L-GDH (mL-GDH) adopts a quaternary structure that is radically different from that of related low molecular weight enzymes. Intersubunit contacts in mL-GDH involve a C-terminal domain that we propose as a new fold and a flexible N-terminal segment comprising ACT-like and PAS-type domains that could act as metabolic sensors for allosteric regulation. These findings uncover unique aspects of the structure-function relationship in the subfamily of L-GDHs. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11606.map.gz emd_11606.map.gz | 13.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11606-v30.xml emd-11606-v30.xml emd-11606.xml emd-11606.xml | 17.7 KB 17.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_11606_fsc.xml emd_11606_fsc.xml | 13.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_11606.png emd_11606.png | 236.6 KB | ||
| マスクデータ |  emd_11606_msk_1.map emd_11606_msk_1.map | 209.3 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-11606.cif.gz emd-11606.cif.gz | 6.9 KB | ||
| その他 |  emd_11606_half_map_1.map.gz emd_11606_half_map_1.map.gz emd_11606_half_map_2.map.gz emd_11606_half_map_2.map.gz | 164.2 MB 164.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11606 http://ftp.pdbj.org/pub/emdb/structures/EMD-11606 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11606 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11606 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_11606_validation.pdf.gz emd_11606_validation.pdf.gz | 837.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_11606_full_validation.pdf.gz emd_11606_full_validation.pdf.gz | 836.8 KB | 表示 | |
| XML形式データ |  emd_11606_validation.xml.gz emd_11606_validation.xml.gz | 20.7 KB | 表示 | |
| CIF形式データ |  emd_11606_validation.cif.gz emd_11606_validation.cif.gz | 27.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11606 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11606 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11606 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11606 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11606.map.gz / 形式: CCP4 / 大きさ: 209.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11606.map.gz / 形式: CCP4 / 大きさ: 209.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
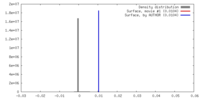
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_11606_msk_1.map emd_11606_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
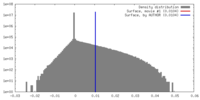
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_11606_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
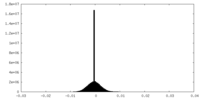
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_11606_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
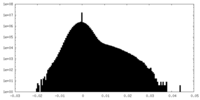
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Cryo-EM map of the large glutamate dehydrogenase composed of 180 ...
| 全体 | 名称: Cryo-EM map of the large glutamate dehydrogenase composed of 180 kDa subunits from Mycobacterium smegmatis (open conformation) |
|---|---|
| 要素 |
|
-超分子 #1: Cryo-EM map of the large glutamate dehydrogenase composed of 180 ...
| 超分子 | 名称: Cryo-EM map of the large glutamate dehydrogenase composed of 180 kDa subunits from Mycobacterium smegmatis (open conformation) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア) |
| 分子量 | 理論値: 705 KDa |
-分子 #1: NAD-specific glutamate dehydrogenase
| 分子 | 名称: NAD-specific glutamate dehydrogenase / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: glutamate dehydrogenase |
|---|---|
| 由来(天然) | 生物種:  Mycolicibacterium smegmatis (strain ATCC 700084 / mc(2)155) (バクテリア) Mycolicibacterium smegmatis (strain ATCC 700084 / mc(2)155) (バクテリア)株: ATCC 700084 / mc(2)155 |
| 分子量 | 理論値: 176.341859 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MHHHHHHENL YFQGAASMIR RLSVAFLSTY RGPQADAPGV TSTGPLAVAA HDDLVSDDLV AAHYRLASMR APGETKAAVY PGDAGSGAA LQIVTDQAPM LVDSVTVLLH RHGIAYTAIM NPVFRVRRGL DGELLDVRPA AEAAPGDGAD ECWILVPITA A ADGEALTE ...文字列: MHHHHHHENL YFQGAASMIR RLSVAFLSTY RGPQADAPGV TSTGPLAVAA HDDLVSDDLV AAHYRLASMR APGETKAAVY PGDAGSGAA LQIVTDQAPM LVDSVTVLLH RHGIAYTAIM NPVFRVRRGL DGELLDVRPA AEAAPGDGAD ECWILVPITA A ADGEALTE ATRLVPGILA EARQIGLDSG AMIAALHGLA NDLATDLEGH FPNAERKEVA ALLRWLADGH FVLLGYQQCV VG DGNAEVD PASRLGVLRL RNDVLPPLTD SDDLLVLAQA TMPSYLRYGA YPYIVVVRES PGASRVIEHR FVGLFTVAAM NAN ALEIPL ISRRVEEALA MAHRDPSHPG QLLRDIIQTI PRPELFALSS KQLLEMALAV VDLGSRRRTL LFLRADHLAH FVSC LVYLP RDRYTTAVRL EMQDILVREL GGAGIDYSAR VSESPWAVVH FTVRLPEGTA ADSVDTSLEN ESRIQDLLTE ATRNW GDRM ISAAAAASIS PAALEHYAHA FPEDYKQAFA PQDAIADISL IEALQDDSVK LVLADTAEDR VWKLTWYLGG HSASLS ELL PMLQSMGVVV LEERPFTLRR TDGLPVWIYQ FKISPHPSIP HAPDAEAQRD TAQRFADAVT AIWHGRVEID RFNELVM RA GLTWQQVVVL RAYAKYLRQA GFPYSQSHIE SVLNENPHTT RSLIDLFEAL FDPSQETDGR RDAQGAAAAV AADIDALV S LDTDRVLRAF ANLIEATLRT NYFVARPDSA RARNVLAFKL NPLVIKELPL PRPKFEIFVY SPRVEGVHLR FGFVARGGL RWSDRREDFR TEILGLVKAQ AVKNAVIVPV GAKGGFVVKR PPTLTGDAAA DREATRAEGV ECYRLFISGL LDVTDNVDKA TGAVVTPPE VVRRDGEDAY LVVAADKGTA TFSDIANEVA KSYGFWLGDA FASGGSIGYD HKAMGITAKG AWESVKRHFR E MGVDTQTQ DFTVVGIGDM SGDVFGNGML LSKHIRLVAA FDHRDIFLDP NPDAGRSWDE RKRLFDLPRS SWADYDKSLI SE GGGVYSR QQKSIPISPQ VRTALGLDAD VEELTPPALI KAILKAPVDL LWNGGIGTYI KAETEADADV GDRANDQIRV CGN QVRAKV IGEGGNLGVT ALGRIEFDLA GGRINTDALD NSAGVDCSDH EVNIKILIDS AVTAGKVTPE ERTELLLSMT DEVG ELVLA DNRDQNDLMG TSRANAASLL SVHARMIKDL VDNRGLNREL EALPSEKEIR RRADAGIGLT SPELATLMAH VKLAL KDDV LASDLPDQEV FASRLPYYFP TRLREELHGE IRSHQLRREI ITTMLVNDLV DTAGISYAYR ITEDVGVGPV DAVRSY VAI NAIFGIGDVW RRIRAAGDAG VPTSVTDRMT LDLRRLVDRA GRWLLNYRPQ PLAVGAEINR FGAKVAALTP RMSEWLR GD DKAIVSKEAG DFASHGVPED LAYHIATGLY QYSLLDVIDI ADIVDREPDE VADTYFALMD HLGADALLTA VSRLSRDD R WHSLARLAIR DDIYGSLRAL CFDVLAVGEP DENGEEKIAE WETTNSSRVT RARRTLTEIY KDGEQDLATL SVAARQIRS MTRTSGTGTT G UniProtKB: NAD-specific glutamate dehydrogenase |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL |
|---|---|
| 緩衝液 | pH: 6 |
| グリッド | モデル: Quantifoil / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - 画像ごとのフレーム数: 1-20 / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 最大 デフォーカス(補正後): 3.2600000000000002 µm 最小 デフォーカス(補正後): 0.67 µm / 倍率(補正後): 47170 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 詳細 | Model fitting into the cryo-EM map was performed using the programs UCSF Chimera (Pettersen et al., 2004), Namdinator (Kidmose et al., 2019), phenix.real_space_refine (Afonine et al., 2018) and Coot (Emsley, Lohkamp, Scott, & Cowtan, 2010). Residues 500-1588 from the crystal structure of Se-Met mL-GDH180 (PDB code 7JSR) were fitted into the cryo-EM map. Se-methionine residues were replaced by methionine residues using Coot (Emsley et al., 2010) and the model was finally refined employing phenix.real_space_refine (Afonine et al., 2018) with NCS and secondary structure restraints. |
|---|---|
| 精密化 | プロトコル: OTHER |
| 得られたモデル |  PDB-7a1d: |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)