+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10959 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
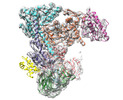
| タイトル | Cryo-EM structure of the ARP2/3 1B5CL isoform complex. | |||||||||
 マップデータ マップデータ | cryo-EM structure of the ARP2/3 1B5CL isoform complex. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Cytoskeleton / STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報tubulobulbar complex / meiotic chromosome movement towards spindle pole / cytosolic transport / growth cone leading edge / muscle cell projection membrane / meiotic cytokinesis / spindle localization / actin polymerization-dependent cell motility / Arp2/3 protein complex / asymmetric cell division ...tubulobulbar complex / meiotic chromosome movement towards spindle pole / cytosolic transport / growth cone leading edge / muscle cell projection membrane / meiotic cytokinesis / spindle localization / actin polymerization-dependent cell motility / Arp2/3 protein complex / asymmetric cell division / Arp2/3 complex-mediated actin nucleation / actin nucleation / actin cap / regulation of actin filament polymerization / establishment or maintenance of cell polarity / positive regulation of actin filament polymerization / filamentous actin / brush border / positive regulation of double-strand break repair via homologous recombination / cilium assembly / RHO GTPases Activate WASPs and WAVEs / positive regulation of lamellipodium assembly / positive regulation of substrate adhesion-dependent cell spreading / EPHB-mediated forward signaling / actin filament polymerization / cellular response to nerve growth factor stimulus / cell projection / FCGR3A-mediated phagocytosis / structural constituent of cytoskeleton / Regulation of actin dynamics for phagocytic cup formation / cellular response to type II interferon / response to estrogen / azurophil granule lumen / cell-cell junction / actin filament binding / actin cytoskeleton / cell migration / lamellipodium / response to estradiol / Clathrin-mediated endocytosis / site of double-strand break / ficolin-1-rich granule lumen / endosome / neuron projection / focal adhesion / glutamatergic synapse / Neutrophil degranulation / enzyme binding / positive regulation of transcription by RNA polymerase II / extracellular exosome / extracellular region / nucleoplasm / ATP binding / membrane / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.2 Å | |||||||||
 データ登録者 データ登録者 | von Loeffelholz O / Moores C | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Biol Open / 年: 2020 ジャーナル: Biol Open / 年: 2020タイトル: Cryo-EM of human Arp2/3 complexes provides structural insights into actin nucleation modulation by ARPC5 isoforms. 著者: Ottilie von Loeffelholz / Andrew Purkiss / Luyan Cao / Svend Kjaer / Naoko Kogata / Guillaume Romet-Lemonne / Michael Way / Carolyn A Moores /   要旨: The Arp2/3 complex regulates many cellular processes by stimulating formation of branched actin filament networks. Because three of its seven subunits exist as two different isoforms, mammals produce ...The Arp2/3 complex regulates many cellular processes by stimulating formation of branched actin filament networks. Because three of its seven subunits exist as two different isoforms, mammals produce a family of Arp2/3 complexes with different properties that may be suited to different physiological contexts. To shed light on how isoform diversification affects Arp2/3 function, we determined a 4.2 Å resolution cryo-EM structure of the most active human Arp2/3 complex containing ARPC1B and ARPC5L, and compared it with the structure of the least active ARPC1A-ARPC5-containing complex. The architecture of each isoform-specific Arp2/3 complex is the same. Strikingly, however, the N-terminal half of ARPC5L is partially disordered compared to ARPC5, suggesting that this region of ARPC5/ARPC5L is an important determinant of complex activity. Confirming this idea, the nucleation activity of Arp2/3 complexes containing hybrid ARPC5/ARPC5L subunits is higher when the ARPC5L N-terminus is present, thereby providing insight into activity differences between the different Arp2/3 complexes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10959.map.gz emd_10959.map.gz | 5.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10959-v30.xml emd-10959-v30.xml emd-10959.xml emd-10959.xml | 17.5 KB 17.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_10959.png emd_10959.png | 201.9 KB | ||
| Filedesc metadata |  emd-10959.cif.gz emd-10959.cif.gz | 6.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10959 http://ftp.pdbj.org/pub/emdb/structures/EMD-10959 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10959 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10959 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10959_validation.pdf.gz emd_10959_validation.pdf.gz | 218.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10959_full_validation.pdf.gz emd_10959_full_validation.pdf.gz | 217.5 KB | 表示 | |
| XML形式データ |  emd_10959_validation.xml.gz emd_10959_validation.xml.gz | 5.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10959 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10959 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10959 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10959 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10959.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10959.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | cryo-EM structure of the ARP2/3 1B5CL isoform complex. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Arp2/3
| 全体 | 名称: Arp2/3 |
|---|---|
| 要素 |
|
-超分子 #1: Arp2/3
| 超分子 | 名称: Arp2/3 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#7 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 250 kDa/nm |
-分子 #1: Actin-related protein 3
| 分子 | 名称: Actin-related protein 3 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 47.428031 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAGRLPACVV DCGTGYTKLG YAGNTEPQFI IPSCIAIKES AKVGDQAQRR VMKGVDDLDF FIGDEAIEKP TYATKWPIRH GIVEDWDLM ERFMEQVIFK YLRAEPEDHY FLLTEPPLNT PENREYTAEI MFESFNVPGL YIAVQAVLAL AASWTSRQVG E RTLTGTVI ...文字列: MAGRLPACVV DCGTGYTKLG YAGNTEPQFI IPSCIAIKES AKVGDQAQRR VMKGVDDLDF FIGDEAIEKP TYATKWPIRH GIVEDWDLM ERFMEQVIFK YLRAEPEDHY FLLTEPPLNT PENREYTAEI MFESFNVPGL YIAVQAVLAL AASWTSRQVG E RTLTGTVI DSGDGVTHVI PVAEGYVIGS CIKHIPIAGR DITYFIQQLL RDREVGIPPE QSLETAKAVK ERYSYVCPDL VK EFNKYDT DGSKWIKQYT GINAISKKEF SIDVGYERFL GPEIFFHPEF ANPDFTQPIS EVVDEVIQNC PIDVRRPLYK NIV LSGGST MFRDFGRRLQ RDLKRTVDAR LKLSEELSGG RLKPKPIDVQ VITHHMQRYA VWFGGSMLAS TPEFYQVCHT KKDY EEIGP SICRHNPVFG VMS UniProtKB: Actin-related protein 3 |
-分子 #2: ARPC1B
| 分子 | 名称: ARPC1B / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 41.004781 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAYHSFLVEP ISCHAWNKDR TQIAICPNNH EVHIYEKSGA KWTKVHELKE HNGQVTGIDW APESNRIVTC GTDRNAYVWT LKGRTWKPT LVILRINRAA RCVRWAPNEN KFAVGSGSRV ISICYFEQEN DWWVCKHIKK PIRSTVLSLD WHPNNVLLAA G SCDFKCRI ...文字列: MAYHSFLVEP ISCHAWNKDR TQIAICPNNH EVHIYEKSGA KWTKVHELKE HNGQVTGIDW APESNRIVTC GTDRNAYVWT LKGRTWKPT LVILRINRAA RCVRWAPNEN KFAVGSGSRV ISICYFEQEN DWWVCKHIKK PIRSTVLSLD WHPNNVLLAA G SCDFKCRI FSAYIKEVEE RPAPTPWGSK MPFGELMFES SSSCGWVHGV CFSASGSRVA WVSHDSTVCL ADADKKMAVA TL ASETLPL LALTFITDNS LVAAGHDCFP VLFTYDAAAG MLSFGGRLDV PKQSSQRGLT ARERFQNLDK KASSEGGTAA GAG LDSLHK NSVSQISVLS GGKAKCSQFC TTGMDGGMSI WDVKSLESAL KDLKIK UniProtKB: Actin-related protein 2/3 complex subunit 1B |
-分子 #3: Actin-related protein 2/3 complex subunit 2
| 分子 | 名称: Actin-related protein 2/3 complex subunit 2 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 34.386043 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MILLEVNNRI IEETLALKFE NAAAGNKPEA VEVTFADFDG VLYHISNPNG DKTKVMVSIS LKFYKELQAH GADELLKRVY GSFLVNPES GYNVSLLYDL ENLPASKDSI VHQAGMLKRN CFASVFEKYF QFQEEGKEGE NRAVIHYRDD ETMYVESKKD R VTVVFSTV ...文字列: MILLEVNNRI IEETLALKFE NAAAGNKPEA VEVTFADFDG VLYHISNPNG DKTKVMVSIS LKFYKELQAH GADELLKRVY GSFLVNPES GYNVSLLYDL ENLPASKDSI VHQAGMLKRN CFASVFEKYF QFQEEGKEGE NRAVIHYRDD ETMYVESKKD R VTVVFSTV FKDDDDVVIG KVFMQEFKEG RRASHTAPQV LFSHREPPLE LKDTDAAVGD NIGYITFVLF PRHTNASARD NT INLIHTF RDYLHYHIKC SKAYIHTRMR AKTSDFLKVL NRARPDAEKK EMKTITGKTF SSR UniProtKB: Actin-related protein 2/3 complex subunit 2 |
-分子 #4: Actin-related protein 2/3 complex subunit 3
| 分子 | 名称: Actin-related protein 2/3 complex subunit 3 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 20.572666 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPAYHSSLMD PDTKLIGNMA LLPIRSQFKG PAPRETKDTD IVDEAIYYFK ANVFFKNYEI KNEADRTLIY ITLYISECLK KLQKCNSKS QGEKEMYTLG ITNFPIPGEP GFPLNAIYAK PANKQEDEVM RAYLQQLRQE TGLRLCEKVF DPQNDKPSKW W TCFVKRQF MNKSLSGPGQ UniProtKB: Actin-related protein 2/3 complex subunit 3 |
-分子 #5: Actin-related protein 2
| 分子 | 名称: Actin-related protein 2 / タイプ: protein_or_peptide / ID: 5 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 44.818711 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDSQGRKVVV CDNGTGFVKC GYAGSNFPEH IFPAIVGRPI IRSTTKVGNI EIKDLMVGDE ASELRSMLEV NYPMENGIVR NWDDMKHLW DYTFGPEKLN IDTRNCKILL TEPPMNPTKN REKIVEVMFE TYQFSGVYVA IQAVLTLYAQ GLLTGVVVDS G DGVTHICP ...文字列: MDSQGRKVVV CDNGTGFVKC GYAGSNFPEH IFPAIVGRPI IRSTTKVGNI EIKDLMVGDE ASELRSMLEV NYPMENGIVR NWDDMKHLW DYTFGPEKLN IDTRNCKILL TEPPMNPTKN REKIVEVMFE TYQFSGVYVA IQAVLTLYAQ GLLTGVVVDS G DGVTHICP VYEGFSLPHL TRRLDIAGRD ITRYLIKLLL LRGYAFNHSA DFETVRMIKE KLCYVGYNIE QEQKLALETT VL VESYTLP DGRIIKVGGE RFEAPEALFQ PHLINVEGVG VAELLFNTIQ AADIDTRSEF YKHIVLSGGS TMYPGLPSRL ERE LKQLYL ERVLKGDVEK LSKFKIRIED PPRRKHMVFL GGAVLADIMK DKDNFWMTRQ EYQEKGVRVL EKLGVTVR UniProtKB: Actin-related protein 2 |
-分子 #6: Actin-related protein 2/3 complex subunit 5-like protein
| 分子 | 名称: Actin-related protein 2/3 complex subunit 5-like protein タイプ: protein_or_peptide / ID: 6 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 16.96418 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MARNTLSSRF RRVDIDEFDE NKFVDEQEEA AAAAAEPGPD PSEVDGLLRQ GDMLRAFHAA LRNSPVNTKN QAVKERAQGV VLKVLTNFK SSEIEQAVQS LDRNGVDLLM KYIYKGFEKP TENSSAVLLQ WHEKALAVGG LGSIIRVLTA RKTV UniProtKB: Actin-related protein 2/3 complex subunit 5-like protein |
-分子 #7: Actin-related protein 2/3 complex subunit 4
| 分子 | 名称: Actin-related protein 2/3 complex subunit 4 / タイプ: protein_or_peptide / ID: 7 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 19.697047 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTATLRPYLS AVRATLQAAL CLENFSSQVV ERHNKPEVEV RSSKELLLQP VTISRNEKEK VLIEGSINSV RVSIAVKQAD EIEKILCHK FMRFMMMRAE NFFILRRKPV EGYDISFLIT NFHTEQMYKH KLVDFVIHFM EEIDKEISEM KLSVNARARI V AEEFLKNF UniProtKB: Actin-related protein 2/3 complex subunit 4 |
-分子 #8: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 8 / コピー数: 2 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.25 mg/mL |
|---|---|
| 緩衝液 | pH: 7 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 4.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 101606 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー