+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10857 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of Tetrahymena thermophila mitochondrial ATP synthase - Fo-wing region | ||||||||||||
 マップデータ マップデータ | Local-resolution filtered full map of T. thermophila ATP synthase Fo-wing region | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | mitochondria / ATP synthase / oxidoreductase / NAD / MEMBRANE PROTEIN | ||||||||||||
| 機能・相同性 | Sulphide quinone-reductase / sulfide oxidation, using sulfide:quinone oxidoreductase / sulfide:quinone oxidoreductase activity / FAD/NAD(P)-binding domain / Pyridine nucleotide-disulphide oxidoreductase / FAD binding / FAD/NAD(P)-binding domain superfamily / mitochondrion / Oxidoreductase, putative 機能・相同性情報 機能・相同性情報 | ||||||||||||
| 生物種 |  | ||||||||||||
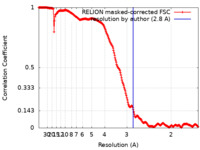
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.8 Å | ||||||||||||
 データ登録者 データ登録者 | Kock Flygaard R / Muhleip A | ||||||||||||
| 資金援助 |  スウェーデン, 3件 スウェーデン, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2020 ジャーナル: Nat Commun / 年: 2020タイトル: Type III ATP synthase is a symmetry-deviated dimer that induces membrane curvature through tetramerization. 著者: Rasmus Kock Flygaard / Alexander Mühleip / Victor Tobiasson / Alexey Amunts /  要旨: Mitochondrial ATP synthases form functional homodimers to induce cristae curvature that is a universal property of mitochondria. To expand on the understanding of this fundamental phenomenon, we ...Mitochondrial ATP synthases form functional homodimers to induce cristae curvature that is a universal property of mitochondria. To expand on the understanding of this fundamental phenomenon, we characterized the unique type III mitochondrial ATP synthase in its dimeric and tetrameric form. The cryo-EM structure of a ciliate ATP synthase dimer reveals an unusual U-shaped assembly of 81 proteins, including a substoichiometrically bound ATPTT2, 40 lipids, and co-factors NAD and CoQ. A single copy of subunit ATPTT2 functions as a membrane anchor for the dimeric inhibitor IF. Type III specific linker proteins stably tie the ATP synthase monomers in parallel to each other. The intricate dimer architecture is scaffolded by an extended subunit-a that provides a template for both intra- and inter-dimer interactions. The latter results in the formation of tetramer assemblies, the membrane part of which we determined to 3.1 Å resolution. The structure of the type III ATP synthase tetramer and its associated lipids suggests that it is the intact unit propagating the membrane curvature. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10857.map.gz emd_10857.map.gz | 472.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10857-v30.xml emd-10857-v30.xml emd-10857.xml emd-10857.xml | 15.8 KB 15.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_10857_fsc.xml emd_10857_fsc.xml | 21.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_10857.png emd_10857.png | 55.4 KB | ||
| マスクデータ |  emd_10857_msk_1.map emd_10857_msk_1.map | 824 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-10857.cif.gz emd-10857.cif.gz | 5.6 KB | ||
| その他 |  emd_10857_half_map_1.map.gz emd_10857_half_map_1.map.gz emd_10857_half_map_2.map.gz emd_10857_half_map_2.map.gz | 672.1 MB 669.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10857 http://ftp.pdbj.org/pub/emdb/structures/EMD-10857 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10857 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10857 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10857_validation.pdf.gz emd_10857_validation.pdf.gz | 803.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10857_full_validation.pdf.gz emd_10857_full_validation.pdf.gz | 802.7 KB | 表示 | |
| XML形式データ |  emd_10857_validation.xml.gz emd_10857_validation.xml.gz | 27.8 KB | 表示 | |
| CIF形式データ |  emd_10857_validation.cif.gz emd_10857_validation.cif.gz | 36.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10857 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10857 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10857 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10857 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10857.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10857.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local-resolution filtered full map of T. thermophila ATP synthase Fo-wing region | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
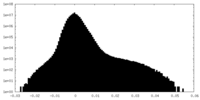
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_10857_msk_1.map emd_10857_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
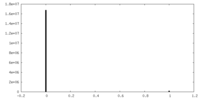
| 密度ヒストグラム |
-ハーフマップ: Half-map 1
| ファイル | emd_10857_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
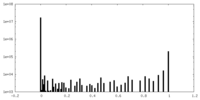
| 密度ヒストグラム |
-ハーフマップ: Half-map 2
| ファイル | emd_10857_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
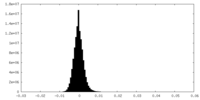
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Mitochondrial ATP synthase, Fo-wing region
| 全体 | 名称: Mitochondrial ATP synthase, Fo-wing region |
|---|---|
| 要素 |
|
-超分子 #1: Mitochondrial ATP synthase, Fo-wing region
| 超分子 | 名称: Mitochondrial ATP synthase, Fo-wing region / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: ATPTT1
| 分子 | 名称: ATPTT1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 54.917816 KDa |
| 配列 | 文字列: MIHCLRNIRT VSALQSKISY NLGGGNKRKK TSGDLDNYDV LFVGANLGGI CSNHFDKDTH GKYKCFVSFD QPINQIYSVR IPYEQQRVR KSEYIHFSKK SINQFTPSEM LAVKEILPEQ NAVVLSSGRR IGYNQLVLAT GLKHDFSQIK GFYEALEHPE H PVYANRDP ...文字列: MIHCLRNIRT VSALQSKISY NLGGGNKRKK TSGDLDNYDV LFVGANLGGI CSNHFDKDTH GKYKCFVSFD QPINQIYSVR IPYEQQRVR KSEYIHFSKK SINQFTPSEM LAVKEILPEQ NAVVLSSGRR IGYNQLVLAT GLKHDFSQIK GFYEALEHPE H PVYANRDP ETWRSAQHKY SKYISNFKSG DGYFCIPEYP YAGEVECFNF FVSDEVWKWA QHHGALSPKH TFTIVNANEK FV HYCDSAD AFIKERLEKR GIRVEYNTKL LEVHQDGQKA TFINTKTGEK SVRDYNNLYS IVPSKRQEFL DKAGLTNGNG LLN VDHQTL QHKKYKNIFG LGDAADLPTT KTFWAGWYQI AVVRNNVKRN LQGQTLNAHY DGFSKVPLFT GHQTLTYVAH SYGG VGNWQ HLKHNNGGIL AWMRYRSWAK GMAKKFQDFY NGARLGPPYH KVLKSFPELP GSPESQQSSG ISKYFPTKTE NKAAH UniProtKB: Oxidoreductase, putative |
-分子 #2: NICOTINAMIDE-ADENINE-DINUCLEOTIDE
| 分子 | 名称: NICOTINAMIDE-ADENINE-DINUCLEOTIDE / タイプ: ligand / ID: 2 / コピー数: 1 / 式: NAD |
|---|---|
| 分子量 | 理論値: 663.425 Da |
| Chemical component information |  ChemComp-NAD: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.75 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 |
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / 平均電子線量: 30.9 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 倍率(公称値): 165000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


























 Z
Z Y
Y X
X