登録情報 データベース : EMDB / ID : EMD-0026タイトル Neurturin-GFRa2-RET extracellular complex Consensus refinement with C2 symmetry applied. 複合体 : Neurturin-GFRa2-RET extracellular complex複合体 : Neurturin複合体 : GDNF family receptor alpha-2タンパク質・ペプチド : GDNF family receptor alpha-2複合体 : Proto-oncogene tyrosine-protein kinase receptor Retタンパク質・ペプチド : Proto-oncogene tyrosine-protein kinase receptor Ret機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 6.3 Å Bigalke JM / Aibara S / Sandmark J / Amunts A 資金援助 Organization Grant number 国 Knut and Alice Wallenberg Foundation Swedish Research Council NT_2015-04107
ジャーナル : Sci Adv / 年 : 2019タイトル : Cryo-EM structure of the activated RET signaling complex reveals the importance of its cysteine-rich domain.著者 : Janna M Bigalke / Shintaro Aibara / Robert Roth / Göran Dahl / Euan Gordon / Sarah Dorbéus / A Amunts / Jenny Sandmark / 要旨 : Signaling through the receptor tyrosine kinase RET is essential during normal development. Both gain- and loss-of-function mutations are involved in a variety of diseases, yet the molecular details ... Signaling through the receptor tyrosine kinase RET is essential during normal development. Both gain- and loss-of-function mutations are involved in a variety of diseases, yet the molecular details of receptor activation have remained elusive. We have reconstituted the complete extracellular region of the RET signaling complex together with Neurturin (NRTN) and GFRα2 and determined its structure at 5.7-Å resolution by cryo-EM. The proteins form an assembly through RET-GFRα2 and RET-NRTN interfaces. Two key interaction points required for RET extracellular domain binding were observed: (i) the calcium-binding site in RET that contacts GFRα2 domain 3 and (ii) the RET cysteine-rich domain interaction with NRTN. The structure highlights the importance of the RET cysteine-rich domain and allows proposition of a model to explain how complex formation leads to RET receptor dimerization and its activation. This provides a framework for targeting RET activity and for further exploration of mechanisms underlying neurological diseases. 履歴 登録 2018年5月23日 - ヘッダ(付随情報) 公開 2018年8月22日 - マップ公開 2019年8月14日 - 更新 2019年12月18日 - 現状 2019年12月18日 処理サイト : PDBe / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 スウェーデン, 2件
スウェーデン, 2件  引用
引用 ジャーナル: Sci Adv / 年: 2019
ジャーナル: Sci Adv / 年: 2019
 構造の表示
構造の表示 SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_0026.map.gz
emd_0026.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-0026-v30.xml
emd-0026-v30.xml emd-0026.xml
emd-0026.xml EMDBヘッダ
EMDBヘッダ emd_0026_fsc.xml
emd_0026_fsc.xml FSCデータファイル
FSCデータファイル emd_0026.png
emd_0026.png emd_0026_msk_1.map
emd_0026_msk_1.map マスクマップ
マスクマップ emd_0026_additional.map.gz
emd_0026_additional.map.gz emd_0026_half_map_1.map.gz
emd_0026_half_map_1.map.gz emd_0026_half_map_2.map.gz
emd_0026_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-0026
http://ftp.pdbj.org/pub/emdb/structures/EMD-0026 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0026
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0026 emd_0026_validation.pdf.gz
emd_0026_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_0026_full_validation.pdf.gz
emd_0026_full_validation.pdf.gz emd_0026_validation.xml.gz
emd_0026_validation.xml.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0026
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0026 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0026
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0026 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_0026.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_0026.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) emd_0026_msk_1.map
emd_0026_msk_1.map 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析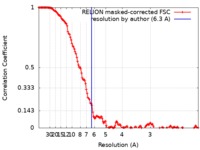

 ムービー
ムービー コントローラー
コントローラー



















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)