+検索条件
-Structure paper
| タイトル | Hub stability in the calcium calmodulin-dependent protein kinase II. |
|---|---|
| ジャーナル・号・ページ | Commun Biol, Vol. 7, Issue 1, Page 766, Year 2024 |
| 掲載日 | 2024年6月25日 |
 著者 著者 | Chih-Ta Chien / Henry Puhl / Steven S Vogel / Justin E Molloy / Wah Chiu / Shahid Khan /   |
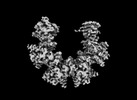
| PubMed 要旨 | The calcium calmodulin protein kinase II (CaMKII) is a multi-subunit ring assembly with a central hub formed by the association domains. There is evidence for hub polymorphism between and within ...The calcium calmodulin protein kinase II (CaMKII) is a multi-subunit ring assembly with a central hub formed by the association domains. There is evidence for hub polymorphism between and within CaMKII isoforms, but the link between polymorphism and subunit exchange has not been resolved. Here, we present near-atomic resolution cryogenic electron microscopy (cryo-EM) structures revealing that hubs from the α and β isoforms, either standalone or within an β holoenzyme, coexist as 12 and 14 subunit assemblies. Single-molecule fluorescence microscopy of Venus-tagged holoenzymes detects intermediate assemblies and progressive dimer loss due to intrinsic holoenzyme lability, and holoenzyme disassembly into dimers upon mutagenesis of a conserved inter-domain contact. Molecular dynamics (MD) simulations show the flexibility of 4-subunit precursors, extracted in-silico from the β hub polymorphs, encompassing the curvature of both polymorphs. The MD explains how an open hub structure also obtained from the β holoenzyme sample could be created by dimer loss and analysis of its cryo-EM dataset reveals how the gap could open further. An assembly model, considering dimer concentration dependence and strain differences between polymorphs, proposes a mechanism for intrinsic hub lability to fine-tune the stoichiometry of αβ heterooligomers for their dynamic localization within synapses in neurons. |
 リンク リンク |  Commun Biol / Commun Biol /  PubMed:38918547 / PubMed:38918547 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.6 - 8.4 Å |
| 構造データ | EMDB-40873, PDB-8syg: EMDB-40955, PDB-8t15: EMDB-40956, PDB-8t17: EMDB-40957, PDB-8t18: EMDB-41070, PDB-8t6k: EMDB-41077, PDB-8t6q: 
EMDB-43385: Cryo-EM map of close dodecameric CaMKII beta holoenzyme T287A T306A T307A |
| 由来 |
|
 キーワード キーワード | SIGNALING PROTEIN / High-order oligomer / Protein Kinase / Signaling / Memory |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について