+検索条件
-Structure paper
| タイトル | Kinesin-8-specific loop-2 controls the dual activities of the motor domain according to tubulin protofilament shape. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 13, Issue 1, Page 4198, Year 2022 |
| 掲載日 | 2022年7月20日 |
 著者 著者 | Byron Hunter / Matthieu P M H Benoit / Ana B Asenjo / Caitlin Doubleday / Daria Trofimova / Corey Frazer / Irsa Shoukat / Hernando Sosa / John S Allingham /   |
| PubMed 要旨 | Kinesin-8s are dual-activity motor proteins that can move processively on microtubules and depolymerize microtubule plus-ends, but their mechanism of combining these distinct activities remains ...Kinesin-8s are dual-activity motor proteins that can move processively on microtubules and depolymerize microtubule plus-ends, but their mechanism of combining these distinct activities remains unclear. We addressed this by obtaining cryo-EM structures (2.6-3.9 Å) of Candida albicans Kip3 in different catalytic states on the microtubule lattice and on a curved microtubule end mimic. We also determined a crystal structure of microtubule-unbound CaKip3-ADP (2.0 Å) and analyzed the biochemical activity of CaKip3 and kinesin-1 mutants. These data reveal that the microtubule depolymerization activity of kinesin-8 originates from conformational changes of its motor core that are amplified by dynamic contacts between its extended loop-2 and tubulin. On curved microtubule ends, loop-1 inserts into preceding motor domains, forming head-to-tail arrays of kinesin-8s that complement loop-2 contacts with curved tubulin and assist depolymerization. On straight tubulin protofilaments in the microtubule lattice, loop-2-tubulin contacts inhibit conformational changes in the motor core, but in the ADP-Pi state these contacts are relaxed, allowing neck-linker docking for motility. We propose that these tubulin shape-induced alternations between pro-microtubule-depolymerization and pro-motility kinesin states, regulated by loop-2, are the key to the dual activity of kinesin-8 motors. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:35859148 / PubMed:35859148 /  PubMed Central PubMed Central |
| 手法 | EM (らせん対称) / EM (単粒子) / X線回折 |
| 解像度 | 2.01 - 3.9 Å |
| 構造データ | EMDB-26074, PDB-7tqx: EMDB-26075, PDB-7tqy: EMDB-26076, PDB-7tqz: EMDB-26077, PDB-7tr0: EMDB-26078, PDB-7tr1: EMDB-26079, PDB-7tr2: EMDB-26080, PDB-7tr3:  PDB-7lff: |
| 化合物 |  ChemComp-ADP:  ChemComp-MG:  ChemComp-HOH:  ChemComp-GTP:  ChemComp-GDP:  ChemComp-TA1:  ChemComp-ANP: 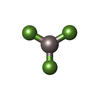 ChemComp-AF3:  ChemComp-SR6: |
| 由来 |
|
 キーワード キーワード | MOTOR PROTEIN / kinesin / microtubule / depolymerase / motility / cytoskeleton / Kip3 / tubulin / dolastatin-10 |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について

















 candida albicans (酵母)
candida albicans (酵母)
 homo sapiens (ヒト)
homo sapiens (ヒト)