+検索条件
-Structure paper
| タイトル | Structural basis for tunable control of actin dynamics by myosin-15 in mechanosensory stereocilia. |
|---|---|
| ジャーナル・号・ページ | Sci Adv, Vol. 8, Issue 29, Page eabl4733, Year 2022 |
| 掲載日 | 2022年7月22日 |
 著者 著者 | Rui Gong / Fangfang Jiang / Zane G Moreland / Matthew J Reynolds / Santiago Espinosa de Los Reyes / Pinar Gurel / Arik Shams / James B Heidings / Michael R Bowl / Jonathan E Bird / Gregory M Alushin /   |
| PubMed 要旨 | The motor protein myosin-15 is necessary for the development and maintenance of mechanosensory stereocilia, and mutations in myosin-15 cause hereditary deafness. In addition to transporting actin ...The motor protein myosin-15 is necessary for the development and maintenance of mechanosensory stereocilia, and mutations in myosin-15 cause hereditary deafness. In addition to transporting actin regulatory machinery to stereocilia tips, myosin-15 directly nucleates actin filament ("F-actin") assembly, which is disrupted by a progressive hearing loss mutation (p.D1647G, ""). Here, we present cryo-electron microscopy structures of myosin-15 bound to F-actin, providing a framework for interpreting the impacts of deafness mutations on motor activity and actin nucleation. Rigor myosin-15 evokes conformational changes in F-actin yet maintains flexibility in actin's D-loop, which mediates inter-subunit contacts, while the mutant locks the D-loop in a single conformation. Adenosine diphosphate-bound myosin-15 also locks the D-loop, which correspondingly blunts actin-polymerization stimulation. We propose myosin-15 enhances polymerization by bridging actin protomers, regulating nucleation efficiency by modulating actin's structural plasticity in a myosin nucleotide state-dependent manner. This tunable regulation of actin polymerization could be harnessed to precisely control stereocilium height. |
 リンク リンク |  Sci Adv / Sci Adv /  PubMed:35857845 / PubMed:35857845 /  PubMed Central PubMed Central |
| 手法 | EM (らせん対称) / EM (単粒子) |
| 解像度 | 2.62 - 4.18 Å |
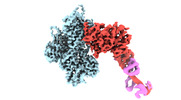
| 構造データ | EMDB-24321, PDB-7r8v: EMDB-24322, PDB-7r91: EMDB-24399, PDB-7rb8: EMDB-24400, PDB-7rb9: EMDB-26459, PDB-7udt: EMDB-26460, PDB-7udu: 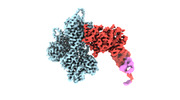 EMDB-26461: cryo-EM structure of the ADP state wild type myosin-15-F-actin complex (symmetry expansion) 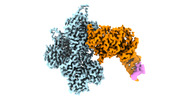 EMDB-26462: cryo-EM structure of the rigor state wild type myosin-15-F-actin complex (symmetry expansion) 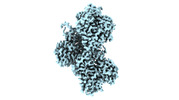 EMDB-26463: cryo-EM structure of the ADP state actin filament (symmetry expansion)  EMDB-26464: Cryo-EM structure of the rigor state Jordan myosin-15-F-actin complex (symmetry expansion) |
| 化合物 |  ChemComp-ADP:  ChemComp-MG: |
| 由来 |
|
 キーワード キーワード |  CELL ADHESION (細胞接着) / filamentous actin / CELL ADHESION (細胞接着) / filamentous actin /  cytoskeleton (細胞骨格) / cytoskeleton (細胞骨格) /  adhesion (接着) / adhesion (接着) /  contractility / contractility /  MOTOR PROTEIN (モータータンパク質) / myosin motor proteins / MOTOR PROTEIN (モータータンパク質) / myosin motor proteins /  actin cytoskeleton (マイクロフィラメント) / actin cytoskeleton (マイクロフィラメント) /  stereocilia / stereocilia /  deafness (難聴) / deafness (難聴) /  MOTOR PROTEIN/ATP Binding Protein (機関 (機械)) / MOTOR PROTEIN/ATP Binding Protein (機関 (機械)) /  MOTOR PROTEIN-ATP Binding Protein complex (機関 (機械)) MOTOR PROTEIN-ATP Binding Protein complex (機関 (機械)) |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について