+検索条件
-Structure paper
| タイトル | Cryo-EM reveals ligand induced allostery underlying InsPR channel gating. |
|---|---|
| ジャーナル・号・ページ | Cell Res, Vol. 28, Issue 12, Page 1158-1170, Year 2018 |
| 掲載日 | 2018年11月23日 |
 著者 著者 | Guizhen Fan / Mariah R Baker / Zhao Wang / Alexander B Seryshev / Steven J Ludtke / Matthew L Baker / Irina I Serysheva /  |
| PubMed 要旨 | Inositol-1,4,5-trisphosphate receptors (InsPRs) are cation channels that mobilize Ca from intracellular stores in response to a wide range of cellular stimuli. The paradigm of InsPR activation is the ...Inositol-1,4,5-trisphosphate receptors (InsPRs) are cation channels that mobilize Ca from intracellular stores in response to a wide range of cellular stimuli. The paradigm of InsPR activation is the coupled interplay between binding of InsP and Ca that switches the ion conduction pathway between closed and open states to enable the passage of Ca through the channel. However, the molecular mechanism of how the receptor senses and decodes ligand-binding signals into gating motion remains unknown. Here, we present the electron cryo-microscopy structure of InsPR1 from rat cerebellum determined to 4.1 Å resolution in the presence of activating concentrations of Ca and adenophostin A (AdA), a structural mimetic of InsP and the most potent known agonist of the channel. Comparison with the 3.9 Å-resolution structure of InsPR1 in the Apo-state, also reported herein, reveals the binding arrangement of AdA in the tetrameric channel assembly and striking ligand-induced conformational rearrangements within cytoplasmic domains coupled to the dilation of a hydrophobic constriction at the gate. Together, our results provide critical insights into the mechanistic principles by which ligand-binding allosterically gates InsPR channel. |
 リンク リンク |  Cell Res / Cell Res /  PubMed:30470765 / PubMed:30470765 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.9 - 4.3 Å |
| 構造データ | EMDB-9243: Structure of full-length IP3R1 channel bound with Adenophostin A (composite) EMDB-9244: Structure of full-length IP3R1 channel in Apo-state (composite)  EMDB-9245:  EMDB-9246:  EMDB-9247:  EMDB-9248: |
| 化合物 | 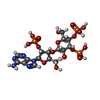 ChemComp-JYP: |
| 由来 |
|
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  inositol 1 (イノシトール) / 4 / 5-trisphosphate receptor / calcium release channel / neuronal type 1 / adenophostin A / IP3R-channel activator inositol 1 (イノシトール) / 4 / 5-trisphosphate receptor / calcium release channel / neuronal type 1 / adenophostin A / IP3R-channel activator |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について








