+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7qig | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
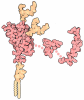
| タイトル | Infectious mouse-adapted RML scrapie prion fibril purified from terminally-infected mouse brains | |||||||||||||||
 要素 要素 | Major prion protein | |||||||||||||||
 キーワード キーワード | PROTEIN FIBRIL /  Prion (プリオン) / Prion (プリオン) /  Amyloid (アミロイド) / PrP / Amyloid (アミロイド) / PrP /  Prion protein / mouse RML scrapie strain / ex vivo prion Prion protein / mouse RML scrapie strain / ex vivo prion | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process /  lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity /  glycosaminoglycan binding / negative regulation of interleukin-17 production / ATP-dependent protein binding / regulation of potassium ion transmembrane transport ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process / glycosaminoglycan binding / negative regulation of interleukin-17 production / ATP-dependent protein binding / regulation of potassium ion transmembrane transport ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process /  lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity /  glycosaminoglycan binding / negative regulation of interleukin-17 production / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / nucleobase-containing compound metabolic process / response to copper ion / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / cuprous ion binding / activation of protein kinase activity / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / intracellular copper ion homeostasis / positive regulation of protein targeting to membrane / negative regulation of long-term synaptic potentiation / response to cadmium ion / side of membrane / glycosaminoglycan binding / negative regulation of interleukin-17 production / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / nucleobase-containing compound metabolic process / response to copper ion / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / cuprous ion binding / activation of protein kinase activity / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / intracellular copper ion homeostasis / positive regulation of protein targeting to membrane / negative regulation of long-term synaptic potentiation / response to cadmium ion / side of membrane /  封入体 / regulation of peptidyl-tyrosine phosphorylation / cellular response to copper ion / neuron projection maintenance / molecular condensate scaffold activity / 封入体 / regulation of peptidyl-tyrosine phosphorylation / cellular response to copper ion / neuron projection maintenance / molecular condensate scaffold activity /  tubulin binding / protein sequestering activity / negative regulation of protein phosphorylation / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity / tubulin binding / protein sequestering activity / negative regulation of protein phosphorylation / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity /  terminal bouton / cellular response to amyloid-beta / positive regulation of neuron apoptotic process / terminal bouton / cellular response to amyloid-beta / positive regulation of neuron apoptotic process /  regulation of protein localization / positive regulation of peptidyl-tyrosine phosphorylation / cellular response to xenobiotic stimulus / regulation of protein localization / positive regulation of peptidyl-tyrosine phosphorylation / cellular response to xenobiotic stimulus /  signaling receptor activity / signaling receptor activity /  amyloid-beta binding / protein-folding chaperone binding / amyloid-beta binding / protein-folding chaperone binding /  microtubule binding / microtubule binding /  核膜 / response to oxidative stress / 核膜 / response to oxidative stress /  protease binding / mitochondrial outer membrane / transmembrane transporter binding / protease binding / mitochondrial outer membrane / transmembrane transporter binding /  postsynaptic density / learning or memory / molecular adaptor activity / postsynaptic density / learning or memory / molecular adaptor activity /  脂質ラフト / copper ion binding / intracellular membrane-bounded organelle / 脂質ラフト / copper ion binding / intracellular membrane-bounded organelle /  樹状突起 / protein-containing complex binding / negative regulation of apoptotic process / 樹状突起 / protein-containing complex binding / negative regulation of apoptotic process /  ゴルジ体 / ゴルジ体 /  細胞膜 / 細胞膜 /  小胞体 / 小胞体 /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  metal ion binding / metal ion binding /  細胞膜 / 細胞膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) | |||||||||||||||
| 手法 |  電子顕微鏡法 / らせん対称体再構成法 / 電子顕微鏡法 / らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.7 Å クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||||||||
 データ登録者 データ登録者 | Manka, S.W. / Zhang, W. / Wenborn, A. / Betts, J. / Joiner, S. / Saibil, H.R. / Collinge, J. / Wadsworth, J.D.F. | |||||||||||||||
| 資金援助 |  英国, 4件 英国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: 2.7 Å cryo-EM structure of ex vivo RML prion fibrils. 著者: Szymon W Manka / Wenjuan Zhang / Adam Wenborn / Jemma Betts / Susan Joiner / Helen R Saibil / John Collinge / Jonathan D F Wadsworth /  要旨: Mammalian prions propagate as distinct strains and are composed of multichain assemblies of misfolded host-encoded prion protein (PrP). Here, we present a near-atomic resolution cryo-EM structure of ...Mammalian prions propagate as distinct strains and are composed of multichain assemblies of misfolded host-encoded prion protein (PrP). Here, we present a near-atomic resolution cryo-EM structure of PrP fibrils present in highly infectious prion rod preparations isolated from the brains of RML prion-infected mice. We found that prion rods comprise single-protofilament helical amyloid fibrils that coexist with twisted pairs of the same protofilaments. Each rung of the protofilament is formed by a single PrP monomer with the ordered core comprising PrP residues 94-225, which folds to create two asymmetric lobes with the N-linked glycans and the glycosylphosphatidylinositol anchor projecting from the C-terminal lobe. The overall architecture is comparable to that of recently reported PrP fibrils isolated from the brain of hamsters infected with the 263K prion strain. However, there are marked conformational variations that could result from differences in PrP sequence and/or represent distinguishing features of the distinct prion strains. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7qig.cif.gz 7qig.cif.gz | 76 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7qig.ent.gz pdb7qig.ent.gz | 60.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7qig.json.gz 7qig.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qi/7qig https://data.pdbj.org/pub/pdb/validation_reports/qi/7qig ftp://data.pdbj.org/pub/pdb/validation_reports/qi/7qig ftp://data.pdbj.org/pub/pdb/validation_reports/qi/7qig | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  13989MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 電子顕微鏡画像生データ |  EMPIAR-10992 (タイトル: Infectious mouse-adapted RML scrapie prion fibrils purified from terminally-infected mouse brains EMPIAR-10992 (タイトル: Infectious mouse-adapted RML scrapie prion fibrils purified from terminally-infected mouse brainsData size: 1.0 TB Data #1: Aligned multi-frame micrographs of RML prion fibrils [micrographs - single frame]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 15290.103 Da / 分子数: 3 / 由来タイプ: 天然 / 由来: (天然)   Mus musculus (ハツカネズミ) / 器官: brain Mus musculus (ハツカネズミ) / 器官: brain 脳 / 参照: UniProt: P04925 脳 / 参照: UniProt: P04925 |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Amyloid fibril of mouse PrP from RML--infected mouse brain タイプ: COMPLEX / Entity ID: all / 由来: NATURAL |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:   Mus musculus (ハツカネズミ) / 株: CD-1 / 器官: Brain Mus musculus (ハツカネズミ) / 株: CD-1 / 器官: Brain |
| 緩衝液 | pH: 6.8 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: C-flat-2/2 |
急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1500 nm Bright-field microscopy / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 電子線照射量: 49 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.19.2_4158: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| らせん対称 | 回転角度/サブユニット: -0.64 ° / 軸方向距離/サブユニット: 4.82 Å / らせん対称軸の対称性: C1 | ||||||||||||||||||||||||
3次元再構成 | 解像度: 2.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 119390 / 対称性のタイプ: HELICAL | ||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: AB INITIO MODEL / 空間: REAL | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj