+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7lc6 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM Structure of KdpFABC in E2-P state with BeF3 | ||||||||||||
 要素 要素 | (Potassium-transporting ATPase ...) x 4 | ||||||||||||
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  P-type ATPase / ATP-dependent potassium pump P-type ATPase / ATP-dependent potassium pump | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報P-type K+ transporter / potassium:proton antiporter complex / potassium ion-transporting ATPase complex / P-type potassium transmembrane transporter activity / monoatomic cation transmembrane transport /  potassium ion binding / potassium ion transmembrane transport / potassium ion transport / magnesium ion binding / potassium ion binding / potassium ion transmembrane transport / potassium ion transport / magnesium ion binding /  ATP hydrolysis activity ...P-type K+ transporter / potassium:proton antiporter complex / potassium ion-transporting ATPase complex / P-type potassium transmembrane transporter activity / monoatomic cation transmembrane transport / ATP hydrolysis activity ...P-type K+ transporter / potassium:proton antiporter complex / potassium ion-transporting ATPase complex / P-type potassium transmembrane transporter activity / monoatomic cation transmembrane transport /  potassium ion binding / potassium ion transmembrane transport / potassium ion transport / magnesium ion binding / potassium ion binding / potassium ion transmembrane transport / potassium ion transport / magnesium ion binding /  ATP hydrolysis activity / ATP hydrolysis activity /  ATP binding / ATP binding /  細胞膜 細胞膜類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌) | ||||||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.7 Å クライオ電子顕微鏡法 / 解像度: 3.7 Å | ||||||||||||
 データ登録者 データ登録者 | Sweet, M.E. / Larsen, C. / Pedersen, B.P. / Stokes, D.L. | ||||||||||||
| 資金援助 |  米国, 米国,  デンマーク, 3件 デンマーク, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2021 ジャーナル: Proc Natl Acad Sci U S A / 年: 2021タイトル: Structural basis for potassium transport in prokaryotes by KdpFABC. 著者: Marie E Sweet / Casper Larsen / Xihui Zhang / Michael Schlame / Bjørn P Pedersen / David L Stokes /   要旨: KdpFABC is an oligomeric K transport complex in prokaryotes that maintains ionic homeostasis under stress conditions. The complex comprises a channel-like subunit (KdpA) from the superfamily of K ...KdpFABC is an oligomeric K transport complex in prokaryotes that maintains ionic homeostasis under stress conditions. The complex comprises a channel-like subunit (KdpA) from the superfamily of K transporters and a pump-like subunit (KdpB) from the superfamily of P-type ATPases. Recent structural work has defined the architecture and generated contradictory hypotheses for the transport mechanism. Here, we use substrate analogs to stabilize four key intermediates in the reaction cycle and determine the corresponding structures by cryogenic electron microscopy. We find that KdpB undergoes conformational changes consistent with other representatives from the P-type superfamily, whereas KdpA, KdpC, and KdpF remain static. We observe a series of spherical densities that we assign as K or water and which define a pathway for K transport. This pathway runs through an intramembrane tunnel in KdpA and delivers ions to sites in the membrane domain of KdpB. Our structures suggest a mechanism where ATP hydrolysis is coupled to K transfer between alternative sites in KdpB, ultimately reaching a low-affinity site where a water-filled pathway allows release of K to the cytoplasm. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7lc6.cif.gz 7lc6.cif.gz | 456.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7lc6.ent.gz pdb7lc6.ent.gz | 389.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7lc6.json.gz 7lc6.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/lc/7lc6 https://data.pdbj.org/pub/pdb/validation_reports/lc/7lc6 ftp://data.pdbj.org/pub/pdb/validation_reports/lc/7lc6 ftp://data.pdbj.org/pub/pdb/validation_reports/lc/7lc6 | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Potassium-transporting ATPase ... , 4種, 4分子 ABCD
| #1: タンパク質 | 分子量: 59247.684 Da / 分子数: 1 / 変異: Q116R / 由来タイプ: 組換発現 由来: (組換発現)   Escherichia coli (strain K12) (大腸菌) Escherichia coli (strain K12) (大腸菌)株: K12 / 遺伝子: kdpA, b0698, JW0686 / プラスミド: pSD107 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): TK2498 / 参照: UniProt: P03959 Escherichia coli (大腸菌) / 株 (発現宿主): TK2498 / 参照: UniProt: P03959 |
|---|---|
| #2: タンパク質 | 分子量: 72251.867 Da / 分子数: 1 / 変異: S162A / 由来タイプ: 組換発現 由来: (組換発現)   Escherichia coli (strain K12) (大腸菌) Escherichia coli (strain K12) (大腸菌)株: K12 / 遺伝子: kdpB, b0697, JW0685 / プラスミド: pSD107 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): TK2498 / 参照: UniProt: P03960, P-type K+ transporter Escherichia coli (大腸菌) / 株 (発現宿主): TK2498 / 参照: UniProt: P03960, P-type K+ transporter |
| #3: タンパク質 | 分子量: 22299.225 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)   Escherichia coli (strain K12) (大腸菌) Escherichia coli (strain K12) (大腸菌)株: K12 / 遺伝子: kdpC, b0696, JW0684 / プラスミド: pSD107 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): TK2498 / 参照: UniProt: P03961 Escherichia coli (大腸菌) / 株 (発現宿主): TK2498 / 参照: UniProt: P03961 |
| #4: タンパク質・ペプチド | 分子量: 3071.714 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)   Escherichia coli (strain K12) (大腸菌) Escherichia coli (strain K12) (大腸菌)株: K12 / 遺伝子: kdpF, b4513, JW0687 / プラスミド: pSD107 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): TK2498 / 参照: UniProt: P36937 Escherichia coli (大腸菌) / 株 (発現宿主): TK2498 / 参照: UniProt: P36937 |
-非ポリマー , 4種, 7分子 
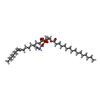





| #5: 化合物 | ChemComp-K / |
|---|---|
| #6: 化合物 | ChemComp-9Y0 / ( |
| #7: 化合物 | ChemComp-MG / |
| #8: 水 | ChemComp-HOH /  水 水 |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: KdpFABC in E2-P intermediate state with BeF3 / タイプ: COMPLEX 詳細: KdpFABC complex solublized in decyl maltopyranoside (DM) detergent. Entity ID: #1-#4 / 由来: RECOMBINANT | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.16 MDa / 実験値: NO | ||||||||||||||||||||||||||||||||||||||||
| 由来(天然) | 生物種:   Escherichia coli (strain K12) (大腸菌) Escherichia coli (strain K12) (大腸菌) | ||||||||||||||||||||||||||||||||||||||||
| 由来(組換発現) | 生物種:   Escherichia coli (大腸菌) / 株: TK2498 / プラスミド Escherichia coli (大腸菌) / 株: TK2498 / プラスミド : pSD107 : pSD107 | ||||||||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 詳細: The beryllium fluoride in the buffer was added to the protein mixture containing all other buffer components in the form of a pre-incubated mixture with the final concentrations 2.5 mM BeSO4 and 10 mM NaF. | ||||||||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 4.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES詳細: DM-solublized KdpFABC complex purified through SEC the same day as grid freezing. Peak fraction diluted to 4.5 mg/mL and complexed with beryllium fluoride solution for >30 min at room ...詳細: DM-solublized KdpFABC complex purified through SEC the same day as grid freezing. Peak fraction diluted to 4.5 mg/mL and complexed with beryllium fluoride solution for >30 min at room temperature prior to application to grid. | ||||||||||||||||||||||||||||||||||||||||
| 試料支持 | 詳細: PELCO easiGlow Glow Discharge Cleaning System used for glow discharge with default settings. グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: UltrAuFoil R1.2/1.3 | ||||||||||||||||||||||||||||||||||||||||
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K 詳細: 3 uL of protein mixture applied to grid. Blot time 4 seconds, blot force 0, no wait before plunging. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 81000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 1000 nm / Cs Bright-field microscopy / 倍率(公称値): 81000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 1000 nm / Cs : 2.7 mm / C2レンズ絞り径: 70 µm / アライメント法: COMA FREE : 2.7 mm / C2レンズ絞り径: 70 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER 最高温度: 77 K / 最低温度: 77 K |
| 撮影 | 平均露光時間: 2.5 sec. / 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 2567 |
| 電子光学装置 | エネルギーフィルター名称 : GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV : GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV |
| 画像スキャン | サンプリングサイズ: 5 µm / 横: 5760 / 縦: 4092 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: dev_3758: / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 1525715 / 詳細: template based picking | ||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 3.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 223443 / アルゴリズム: FOURIER SPACE / 詳細: non-uniform refinement / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL / Target criteria: Correlation coefficient | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 5MRW | ||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー




























 PDBj
PDBj






