+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7ad9 | ||||||
|---|---|---|---|---|---|---|---|
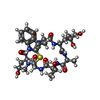
| タイトル | Structure of the Lifeact-F-actin complex | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  STRUCTURAL PROTEIN (タンパク質) / STRUCTURAL PROTEIN (タンパク質) /  Cytoskeleton (細胞骨格) / Cytoskeleton (細胞骨格) /  Actin (アクチン) / Actin (アクチン) /  Lifeact / labelling. Lifeact / labelling. | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報tRNAThr (cytosine32-N3)-methyltransferase / tRNA (cytidine-3-)-methyltransferase activity / tRNA methylation / mating projection tip / cytoskeletal motor activator activity /  tropomyosin binding / tropomyosin binding /  myosin heavy chain binding / mesenchyme migration / myosin heavy chain binding / mesenchyme migration /  troponin I binding / actin filament bundle ...tRNAThr (cytosine32-N3)-methyltransferase / tRNA (cytidine-3-)-methyltransferase activity / tRNA methylation / mating projection tip / cytoskeletal motor activator activity / troponin I binding / actin filament bundle ...tRNAThr (cytosine32-N3)-methyltransferase / tRNA (cytidine-3-)-methyltransferase activity / tRNA methylation / mating projection tip / cytoskeletal motor activator activity /  tropomyosin binding / tropomyosin binding /  myosin heavy chain binding / mesenchyme migration / myosin heavy chain binding / mesenchyme migration /  troponin I binding / actin filament bundle / filamentous actin / actin filament bundle assembly / skeletal muscle thin filament assembly / striated muscle thin filament / skeletal muscle myofibril / actin monomer binding / skeletal muscle fiber development / troponin I binding / actin filament bundle / filamentous actin / actin filament bundle assembly / skeletal muscle thin filament assembly / striated muscle thin filament / skeletal muscle myofibril / actin monomer binding / skeletal muscle fiber development /  stress fiber / stress fiber /  titin binding / actin filament polymerization / titin binding / actin filament polymerization /  filopodium / filopodium /  マイクロフィラメント / マイクロフィラメント /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / calcium-dependent protein binding / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / calcium-dependent protein binding /  actin filament binding / protein-macromolecule adaptor activity / actin filament binding / protein-macromolecule adaptor activity /  lamellipodium / lamellipodium /  cell body / cell body /  hydrolase activity / protein domain specific binding / hydrolase activity / protein domain specific binding /  calcium ion binding / positive regulation of gene expression / magnesium ion binding / calcium ion binding / positive regulation of gene expression / magnesium ion binding /  ATP binding / identical protein binding / ATP binding / identical protein binding /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Oryctolagus cuniculus (ウサギ) Oryctolagus cuniculus (ウサギ)  Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母)synthetic construct (人工物) | ||||||
| 手法 |  電子顕微鏡法 / らせん対称体再構成法 / 電子顕微鏡法 / らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.5 Å クライオ電子顕微鏡法 / 解像度: 3.5 Å | ||||||
 データ登録者 データ登録者 | Belyy, A. / Merino, F. / Sitsel, O. / Raunser, S. | ||||||
 引用 引用 |  ジャーナル: PLoS Biol / 年: 2020 ジャーナル: PLoS Biol / 年: 2020タイトル: Structure of the Lifeact-F-actin complex. 著者: Alexander Belyy / Felipe Merino / Oleg Sitsel / Stefan Raunser /  要旨: Lifeact is a short actin-binding peptide that is used to visualize filamentous actin (F-actin) structures in live eukaryotic cells using fluorescence microscopy. However, this popular probe has been ...Lifeact is a short actin-binding peptide that is used to visualize filamentous actin (F-actin) structures in live eukaryotic cells using fluorescence microscopy. However, this popular probe has been shown to alter cellular morphology by affecting the structure of the cytoskeleton. The molecular basis for such artefacts is poorly understood. Here, we determined the high-resolution structure of the Lifeact-F-actin complex using electron cryo-microscopy (cryo-EM). The structure reveals that Lifeact interacts with a hydrophobic binding pocket on F-actin and stretches over 2 adjacent actin subunits, stabilizing the DNase I-binding loop (D-loop) of actin in the closed conformation. Interestingly, the hydrophobic binding site is also used by actin-binding proteins, such as cofilin and myosin and actin-binding toxins, such as the hypervariable region of TccC3 (TccC3HVR) from Photorhabdus luminescens and ExoY from Pseudomonas aeruginosa. In vitro binding assays and activity measurements demonstrate that Lifeact indeed competes with these proteins, providing an explanation for the altering effects of Lifeact on cell morphology in vivo. Finally, we demonstrate that the affinity of Lifeact to F-actin can be increased by introducing mutations into the peptide, laying the foundation for designing improved actin probes for live cell imaging. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7ad9.cif.gz 7ad9.cif.gz | 336.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7ad9.ent.gz pdb7ad9.ent.gz | 288.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7ad9.json.gz 7ad9.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ad/7ad9 https://data.pdbj.org/pub/pdb/validation_reports/ad/7ad9 ftp://data.pdbj.org/pub/pdb/validation_reports/ad/7ad9 ftp://data.pdbj.org/pub/pdb/validation_reports/ad/7ad9 | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質・ペプチド , 2種, 10分子 ACLEGOPQRS
| #1: タンパク質・ペプチド |  LifeAct Dye LifeAct Dye分子量: 1927.243 Da / 分子数: 5 / 由来タイプ: 合成 詳細: Lifeact. Actin-binding peptide derived from the yeast protein ABP140 由来: (合成)   Saccharomyces cerevisiae (パン酵母) / 参照: UniProt: Q08641*PLUS Saccharomyces cerevisiae (パン酵母) / 参照: UniProt: Q08641*PLUS#3: タンパク質・ペプチド |  / /  |
|---|
-タンパク質 , 1種, 5分子 BDHFI
| #2: タンパク質 |  / Alpha-actin-1 / Alpha-actin-1分子量: 42109.973 Da / 分子数: 5 / 由来タイプ: 天然 / 詳細: Alpha-actin from rabbit skeletal muscle / 由来: (天然)   Oryctolagus cuniculus (ウサギ) / 参照: UniProt: P68135 Oryctolagus cuniculus (ウサギ) / 参照: UniProt: P68135 |
|---|
-非ポリマー , 3種, 15分子 




| #4: 化合物 | ChemComp-ADP /  アデノシン二リン酸 アデノシン二リン酸#5: 化合物 | ChemComp-MG / #6: 化合物 | ChemComp-PO4 /  リン酸塩 リン酸塩 |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 163 kDa/nm / 実験値: NO | ||||||||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||||||||
| 緩衝液 | pH: 8 詳細: 120 mM KCl, 20 mM Tris pH 8, 2 mM MgCl2, 1 mM DTT, and 0.02% w/v Tween-20 | ||||||||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES | ||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのタイプ: Quantifoil R2/1 | ||||||||||||||||||||||||||||||
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 286 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TALOS ARCTICA |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / アライメント法: COMA FREE Bright-field microscopy / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN |
| 撮影 | 平均露光時間: 3 sec. / 電子線照射量: 60 e/Å2 / 検出モード: INTEGRATING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 撮影したグリッド数: 1 / 実像数: 915 |
- 解析
解析
| EMソフトウェア |
| |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | |||||||||||||||||||||||||||
| らせん対称 | 回転角度/サブユニット: -167.18 ° / 軸方向距離/サブユニット: 27.3 Å / らせん対称軸の対称性: C1 | |||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 246423 | |||||||||||||||||||||||||||
3次元再構成 | 解像度: 3.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 223480 / アルゴリズム: BACK PROJECTION / クラス平均像の数: 1 / 対称性のタイプ: HELICAL | |||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 6FHL PDB chain-ID: C |
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj