+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4dg0 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of myristoylated WT catalytic subunit of cAMP-dependent protein kinase in complex with SP20 and AMP-PNP | ||||||
 要素 要素 | (cAMP-dependent protein kinase ... プロテインキナーゼA) x 2 プロテインキナーゼA) x 2 | ||||||
 キーワード キーワード | TRANSFERASE/TRANSFERASE INHIBITOR /  Protein kinase (プロテインキナーゼ) / Protein kinase (プロテインキナーゼ) /  myristoylated (ミリストイル化) / Phosphotransferase of Ser/Thr / Mg / PKI / PKA Regulatory subunits / phosphorylated on S139 / T197 / S338 / myristoylated on G1 / TRANSFERASE-TRANSFERASE INHIBITOR complex myristoylated (ミリストイル化) / Phosphotransferase of Ser/Thr / Mg / PKI / PKA Regulatory subunits / phosphorylated on S139 / T197 / S338 / myristoylated on G1 / TRANSFERASE-TRANSFERASE INHIBITOR complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報spontaneous exocytosis of neurotransmitter / PKA activation in glucagon signalling / CREB1 phosphorylation through the activation of Adenylate Cyclase / negative regulation of meiotic cell cycle / HDL assembly / DARPP-32 events / Rap1 signalling / PKA activation / Vasopressin regulates renal water homeostasis via Aquaporins / Regulation of insulin secretion ...spontaneous exocytosis of neurotransmitter / PKA activation in glucagon signalling / CREB1 phosphorylation through the activation of Adenylate Cyclase / negative regulation of meiotic cell cycle / HDL assembly / DARPP-32 events / Rap1 signalling / PKA activation / Vasopressin regulates renal water homeostasis via Aquaporins / Regulation of insulin secretion / GPER1 signaling / Hedgehog 'off' state / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / Loss of Nlp from mitotic centrosomes / Recruitment of mitotic centrosome proteins and complexes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of NuMA to mitotic centrosomes / Anchoring of the basal body to the plasma membrane / MAPK6/MAPK4 signaling / GLI3 is processed to GLI3R by the proteasome / AURKA Activation by TPX2 / Factors involved in megakaryocyte development and platelet production /  Regulation of PLK1 Activity at G2/M Transition / Regulation of PLK1 Activity at G2/M Transition /  Interleukin-3, Interleukin-5 and GM-CSF signaling / CD209 (DC-SIGN) signaling / RET signaling / Ion homeostasis / VEGFA-VEGFR2 Pathway / nucleotide-activated protein kinase complex / Interleukin-3, Interleukin-5 and GM-CSF signaling / CD209 (DC-SIGN) signaling / RET signaling / Ion homeostasis / VEGFA-VEGFR2 Pathway / nucleotide-activated protein kinase complex /  regulation of cellular respiration / regulation of protein processing / protein localization to lipid droplet / regulation of bicellular tight junction assembly / cellular response to parathyroid hormone stimulus / regulation of cellular respiration / regulation of protein processing / protein localization to lipid droplet / regulation of bicellular tight junction assembly / cellular response to parathyroid hormone stimulus /  cAMP-dependent protein kinase inhibitor activity / cAMP-dependent protein kinase inhibitor activity /  プロテインキナーゼA / cellular response to cold / プロテインキナーゼA / cellular response to cold /  sperm capacitation / regulation of osteoblast differentiation / sperm capacitation / regulation of osteoblast differentiation /  cAMP-dependent protein kinase activity / negative regulation of glycolytic process through fructose-6-phosphate / ciliary base / cAMP-dependent protein kinase activity / negative regulation of glycolytic process through fructose-6-phosphate / ciliary base /  cAMP-dependent protein kinase complex / AMP-activated protein kinase activity / negative regulation of protein import into nucleus / postsynaptic modulation of chemical synaptic transmission / cellular response to glucagon stimulus / protein kinase A regulatory subunit binding / cAMP-dependent protein kinase complex / AMP-activated protein kinase activity / negative regulation of protein import into nucleus / postsynaptic modulation of chemical synaptic transmission / cellular response to glucagon stimulus / protein kinase A regulatory subunit binding /  axoneme / protein kinase A catalytic subunit binding / plasma membrane raft / mesoderm formation / sperm flagellum / negative regulation of smoothened signaling pathway / regulation of proteasomal protein catabolic process / protein kinase A signaling / positive regulation of gluconeogenesis / axoneme / protein kinase A catalytic subunit binding / plasma membrane raft / mesoderm formation / sperm flagellum / negative regulation of smoothened signaling pathway / regulation of proteasomal protein catabolic process / protein kinase A signaling / positive regulation of gluconeogenesis /  regulation of synaptic transmission, glutamatergic / negative regulation of TORC1 signaling / sperm midpiece / regulation of G2/M transition of mitotic cell cycle / protein export from nucleus / protein serine/threonine/tyrosine kinase activity / acrosomal vesicle / positive regulation of protein export from nucleus / neural tube closure / cellular response to glucose stimulus / modulation of chemical synaptic transmission / regulation of synaptic transmission, glutamatergic / negative regulation of TORC1 signaling / sperm midpiece / regulation of G2/M transition of mitotic cell cycle / protein export from nucleus / protein serine/threonine/tyrosine kinase activity / acrosomal vesicle / positive regulation of protein export from nucleus / neural tube closure / cellular response to glucose stimulus / modulation of chemical synaptic transmission /  neuromuscular junction / adenylate cyclase-activating G protein-coupled receptor signaling pathway / positive regulation of insulin secretion / neuromuscular junction / adenylate cyclase-activating G protein-coupled receptor signaling pathway / positive regulation of insulin secretion /  転写後修飾 / 転写後修飾 /  small GTPase binding / presynapse / cellular response to heat / manganese ion binding / postsynapse / peptidyl-serine phosphorylation / small GTPase binding / presynapse / cellular response to heat / manganese ion binding / postsynapse / peptidyl-serine phosphorylation /  樹状突起スパイン / 樹状突起スパイン /  regulation of cell cycle / regulation of cell cycle /  protein kinase activity / nuclear speck / protein domain specific binding / protein serine kinase activity / protein serine/threonine kinase activity / protein kinase activity / nuclear speck / protein domain specific binding / protein serine kinase activity / protein serine/threonine kinase activity /  中心体 / glutamatergic synapse / 中心体 / glutamatergic synapse /  ubiquitin protein ligase binding / positive regulation of cell population proliferation / protein-containing complex binding / ubiquitin protein ligase binding / positive regulation of cell population proliferation / protein-containing complex binding /  protein kinase binding / perinuclear region of cytoplasm / magnesium ion binding / negative regulation of transcription by RNA polymerase II / protein-containing complex / protein kinase binding / perinuclear region of cytoplasm / magnesium ion binding / negative regulation of transcription by RNA polymerase II / protein-containing complex /  ミトコンドリア / ミトコンドリア /  核質 / 核質 /  ATP binding / ATP binding /  細胞核 / 細胞核 /  細胞膜 細胞膜類似検索 - 分子機能 | ||||||
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2 Å 分子置換 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | Bastidas, A.C. / Steichen, J.M. / Taylor, S.S. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2012 ジャーナル: J.Mol.Biol. / 年: 2012タイトル: Role of N-terminal myristylation in the structure and regulation of cAMP-dependent protein kinase. 著者: Bastidas, A.C. / Deal, M.S. / Steichen, J.M. / Keshwani, M.M. / Guo, Y. / Taylor, S.S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4dg0.cif.gz 4dg0.cif.gz | 175.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4dg0.ent.gz pdb4dg0.ent.gz | 145.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4dg0.json.gz 4dg0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/dg/4dg0 https://data.pdbj.org/pub/pdb/validation_reports/dg/4dg0 ftp://data.pdbj.org/pub/pdb/validation_reports/dg/4dg0 ftp://data.pdbj.org/pub/pdb/validation_reports/dg/4dg0 | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-CAMP-dependent protein kinase ... , 2種, 2分子 EI
| #1: タンパク質 |  CAMP-dependent pathway / PKA C-alpha CAMP-dependent pathway / PKA C-alpha分子量: 40737.297 Da / 分子数: 1 / 断片: unp residues 2-351 / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) / 遺伝子: Prkaca, Pkaca / 発現宿主: Mus musculus (ハツカネズミ) / 遺伝子: Prkaca, Pkaca / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P05132, Escherichia coli (大腸菌) / 参照: UniProt: P05132,  プロテインキナーゼA プロテインキナーゼA |
|---|---|
| #2: タンパク質・ペプチド |  CAMP-dependent pathway / PKI-alpha / cAMP-dependent protein kinase inhibitor / muscle/brain isoform CAMP-dependent pathway / PKI-alpha / cAMP-dependent protein kinase inhibitor / muscle/brain isoform分子量: 2199.386 Da / 分子数: 1 / 断片: unp residues 6-25 / Mutation: N20A, A21S / 由来タイプ: 合成 / 由来: (合成)   Mus musculus (ハツカネズミ) / 参照: UniProt: P63248 Mus musculus (ハツカネズミ) / 参照: UniProt: P63248 |
-非ポリマー , 4種, 348分子 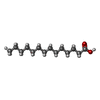






| #3: 化合物 | ChemComp-MYR /  ミリスチン酸 ミリスチン酸 | ||
|---|---|---|---|
| #4: 化合物 | ChemComp-ANP / | ||
| #5: 化合物 | | #6: 水 | ChemComp-HOH / |  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.62 Å3/Da / 溶媒含有率: 53.11 % |
|---|---|
結晶化 | 温度: 277.15 K / pH: 8 詳細: Mother liquor: 10% MPD Protein solution: 50 mM Bicine, 150 mM Ammonium Acetate, 8-10 mg/mL 9% MeOH added to the well immediately before sealing. 8 uL drop size with 1:1 protein:mother liquor, ...詳細: Mother liquor: 10% MPD Protein solution: 50 mM Bicine, 150 mM Ammonium Acetate, 8-10 mg/mL 9% MeOH added to the well immediately before sealing. 8 uL drop size with 1:1 protein:mother liquor, VAPOR DIFFUSION, HANGING DROP, temperature 277.15K, pH 8.0 |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ALS ALS  / ビームライン: 8.2.1 / 波長: 1 / ビームライン: 8.2.1 / 波長: 1 |
| 検出器 | タイプ: ADSC QUANTUM 315 / 検出器: CCD / 日付: 2011年5月13日 |
| 放射 | モノクロメーター: DOUBLE CRYSTAL, SI(111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1 Å / 相対比: 1 : 1 Å / 相対比: 1 |
| 反射 | 解像度: 2→39.37 Å / Num. obs: 31277 / % possible obs: 100 % / Rsym value: 0.114 |
| 反射 シェル | 解像度: 2→2.11 Å / 冗長度: 6.5 % / Mean I/σ(I) obs: 4.2 / Rsym value: 0.387 / % possible all: 100 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 / 解像度: 2→39.37 Å / Cor.coef. Fo:Fc: 0.944 / Cor.coef. Fo:Fc free: 0.92 / SU B: 8.302 / SU ML: 0.104 / 交差検証法: THROUGHOUT / ESU R: 0.18 / ESU R Free: 0.156 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS 分子置換 / 解像度: 2→39.37 Å / Cor.coef. Fo:Fc: 0.944 / Cor.coef. Fo:Fc free: 0.92 / SU B: 8.302 / SU ML: 0.104 / 交差検証法: THROUGHOUT / ESU R: 0.18 / ESU R Free: 0.156 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.4 Å / 溶媒モデル: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 22.22 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→39.37 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2→2.05 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー





























 PDBj
PDBj

























