+ データを開く
データを開く
- 基本情報
基本情報
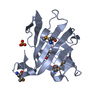
| 登録情報 | データベース: PDB / ID: 1tum | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | MUTT PYROPHOSPHOHYDROLASE-METAL-NUCLEOTIDE-METAL COMPLEX, NMR, 16 STRUCTURES | ||||||
 要素 要素 | MUTATOR MUTT PROTEIN | ||||||
 キーワード キーワード | MUTATOR PROTEIN /  QUATERNARY COMPLEX (第四紀) / NUCLEOSIDE TRIPHOSPHATE PYROPHOSPHOHYDROLASE / MUTT PYROPHOSPHOHYDROLASE-METAL-SUBSTRATE ANALOG COMPLEX QUATERNARY COMPLEX (第四紀) / NUCLEOSIDE TRIPHOSPHATE PYROPHOSPHOHYDROLASE / MUTT PYROPHOSPHOHYDROLASE-METAL-SUBSTRATE ANALOG COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報dGDP catabolic process /  8-oxo-dGTP diphosphatase / 8-oxo-GDP phosphatase activity / 8-oxo-dGTP diphosphatase / 8-oxo-GDP phosphatase activity /  8-oxo-dGDP phosphatase activity / dGTP catabolic process / 8-oxo-7,8-dihydrodeoxyguanosine triphosphate pyrophosphatase activity / 8-oxo-7,8-dihydroguanosine triphosphate pyrophosphatase activity / nucleotide-excision repair / manganese ion binding / 8-oxo-dGDP phosphatase activity / dGTP catabolic process / 8-oxo-7,8-dihydrodeoxyguanosine triphosphate pyrophosphatase activity / 8-oxo-7,8-dihydroguanosine triphosphate pyrophosphatase activity / nucleotide-excision repair / manganese ion binding /  DNA複製 ...dGDP catabolic process / DNA複製 ...dGDP catabolic process /  8-oxo-dGTP diphosphatase / 8-oxo-GDP phosphatase activity / 8-oxo-dGTP diphosphatase / 8-oxo-GDP phosphatase activity /  8-oxo-dGDP phosphatase activity / dGTP catabolic process / 8-oxo-7,8-dihydrodeoxyguanosine triphosphate pyrophosphatase activity / 8-oxo-7,8-dihydroguanosine triphosphate pyrophosphatase activity / nucleotide-excision repair / manganese ion binding / 8-oxo-dGDP phosphatase activity / dGTP catabolic process / 8-oxo-7,8-dihydrodeoxyguanosine triphosphate pyrophosphatase activity / 8-oxo-7,8-dihydroguanosine triphosphate pyrophosphatase activity / nucleotide-excision repair / manganese ion binding /  DNA複製 / DNA複製 /  DNA修復 / magnesium ion binding DNA修復 / magnesium ion binding類似検索 - 分子機能 | ||||||
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌) | ||||||
| 手法 |  溶液NMR 溶液NMR | ||||||
 データ登録者 データ登録者 | Lin, J. / Abeygunawardana, C. / Frick, D.N. / Bessman, M.J. / Mildvan, A.S. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 1997 ジャーナル: Biochemistry / 年: 1997タイトル: Solution structure of the quaternary MutT-M2+-AMPCPP-M2+ complex and mechanism of its pyrophosphohydrolase action. 著者: Lin, J. / Abeygunawardana, C. / Frick, D.N. / Bessman, M.J. / Mildvan, A.S. #1:  ジャーナル: Biochemistry / 年: 1995 ジャーナル: Biochemistry / 年: 1995タイトル: NMR Studies of the Conformations and Location of Nucleotides Bound to the E.Coli Mutt Enzyme 著者: Frick, D.N. / Weber, D.J. / Abeygunawardana, C. / Gittis, A.G. / Bessman, M.J. / Mildvan, A.S. #2:  ジャーナル: Biochemistry / 年: 1995 ジャーナル: Biochemistry / 年: 1995タイトル: Solution Structure of the Mutt Enzyme, a Nucleoside Triphosphate Pyrophosphohydrolase 著者: Abeygunawardana, C. / Weber, D.J. / Gittis, A.G. / Frick, D.N. / Lin, J. / Miller, A.F. / Bessman, M.J. / Mildvan, A.S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1tum.cif.gz 1tum.cif.gz | 679.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1tum.ent.gz pdb1tum.ent.gz | 582.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1tum.json.gz 1tum.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/tu/1tum https://data.pdbj.org/pub/pdb/validation_reports/tu/1tum ftp://data.pdbj.org/pub/pdb/validation_reports/tu/1tum ftp://data.pdbj.org/pub/pdb/validation_reports/tu/1tum | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 14945.029 Da / 分子数: 1 / 由来タイプ: 組換発現 / 詳細: MUTT-MG(2+)-AMPCPP-MG(2+) COMPLEX / 由来: (組換発現)   Escherichia coli (大腸菌) / 株: K12-I7023 / プラスミド: PET MUTT, T7 PROMOTER / 遺伝子 (発現宿主): MUTT / 発現宿主: Escherichia coli (大腸菌) / 株: K12-I7023 / プラスミド: PET MUTT, T7 PROMOTER / 遺伝子 (発現宿主): MUTT / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): HMS174 (DE3) Escherichia coli (大腸菌) / 株 (発現宿主): HMS174 (DE3)参照: UniProt: P08337,  加水分解酵素; 酸無水物に作用; リン含有酸無水物に作用 加水分解酵素; 酸無水物に作用; リン含有酸無水物に作用 |
|---|---|
| #2: 化合物 | ChemComp-MG / |
| #3: 化合物 | ChemComp-APC / |
| #4: 化合物 | ChemComp-CON / |
| #5: 水 | ChemComp-HOH /  水 水 |
-実験情報
-実験
| 実験 | 手法:  溶液NMR 溶液NMR |
|---|
- 試料調製
試料調製
| 試料状態 | pH: 7.6 / 温度: 305 K |
|---|---|
結晶化 | *PLUS 手法: その他 / 詳細: NMR |
- 解析
解析
| ソフトウェア |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR software | 名称:  X-PLOR / バージョン: 3.1 / 開発者: BRUNGER / 分類: 精密化 X-PLOR / バージョン: 3.1 / 開発者: BRUNGER / 分類: 精密化 | ||||||||||||
| NMRアンサンブル | 登録したコンフォーマーの数: 16 |
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj