登録情報 データベース : PDB / ID : 1o0cタイトル CRYSTAL STRUCTURE OF L-GLUTAMATE AND AMPCPP BOUND TO GLUTAMINE AMINOACYL TRNA SYNTHETASE Glutaminyl tRNA Glutaminyl-tRNA synthetase キーワード / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Escherichia coli (大腸菌)手法 / / / 解像度 : 2.7 Å データ登録者 Bullock, T.L. / Perona, J.J. ジャーナル : J.Mol.Biol. / 年 : 2003タイトル : Amino Acid Discrimination by a class I aminoacyl-tRNA synthetase specified by negative determinants著者 : Bullock, T.L. / Uter, N. / Nissan, T.A. / Perona, J.J. 履歴 登録 2003年2月20日 登録サイト / 処理サイト 改定 1.0 2003年4月15日 Provider / タイプ 改定 1.1 2008年4月29日 Group 改定 1.2 2011年7月13日 Group 改定 1.3 2015年1月21日 Group 改定 1.4 2021年10月27日 Group / Derived calculations / カテゴリ / struct_ref_seq_dif / struct_siteItem _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id 改定 1.5 2024年2月14日 Group / カテゴリ / chem_comp_bond
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 グルタミンtRNAリガーゼ /
グルタミンtRNAリガーゼ /  glutamine-tRNA ligase activity / glutaminyl-tRNA aminoacylation / glutamyl-tRNA aminoacylation /
glutamine-tRNA ligase activity / glutaminyl-tRNA aminoacylation / glutamyl-tRNA aminoacylation /  ATP binding /
ATP binding /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Escherichia coli (大腸菌)
Escherichia coli (大腸菌) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  フーリエ合成 / 解像度: 2.7 Å
フーリエ合成 / 解像度: 2.7 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Mol.Biol. / 年: 2003
ジャーナル: J.Mol.Biol. / 年: 2003 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1o0c.cif.gz
1o0c.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1o0c.ent.gz
pdb1o0c.ent.gz PDB形式
PDB形式 1o0c.json.gz
1o0c.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/o0/1o0c
https://data.pdbj.org/pub/pdb/validation_reports/o0/1o0c ftp://data.pdbj.org/pub/pdb/validation_reports/o0/1o0c
ftp://data.pdbj.org/pub/pdb/validation_reports/o0/1o0c リンク
リンク 集合体
集合体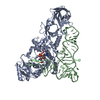
 要素
要素 QARS / E.C.6.1.1.18 / Glutamine--tRNA ligase / glutamine tRNA synthetase / GlnRS /
QARS / E.C.6.1.1.18 / Glutamine--tRNA ligase / glutamine tRNA synthetase / GlnRS / 
 Escherichia coli (大腸菌) / 遺伝子: GLNS / プラスミド: pSJW1 / 発現宿主:
Escherichia coli (大腸菌) / 遺伝子: GLNS / プラスミド: pSJW1 / 発現宿主: 
 Escherichia coli (大腸菌) / 株 (発現宿主): Bl21-DE3 (PlysS)
Escherichia coli (大腸菌) / 株 (発現宿主): Bl21-DE3 (PlysS) グルタミンtRNAリガーゼ
グルタミンtRNAリガーゼ






 硫酸塩
硫酸塩 グルタミン酸
グルタミン酸 アデニル酸
アデニル酸 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  SRS
SRS  / ビームライン: PX9.6 / 波長: 1 Å
/ ビームライン: PX9.6 / 波長: 1 Å : 1 Å / 相対比: 1
: 1 Å / 相対比: 1  解析
解析 :
:  フーリエ合成 / 解像度: 2.7→6 Å / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber
フーリエ合成 / 解像度: 2.7→6 Å / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber : 0.279 / Rfactor Rwork
: 0.279 / Rfactor Rwork : 0.221
: 0.221  ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj






































