+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1h8u | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal Structure of the Eosinophil Major Basic Protein at 1.8A: An Atypical Lectin with a Paradigm Shift in Specificity | ||||||
 要素 要素 | EOSINOPHIL GRANULE MAJOR BASIC PROTEIN 1 | ||||||
 キーワード キーワード |  LECTIN (レクチン) / EOSINOPHIL GRANULE PROTEIN / EMBP LECTIN (レクチン) / EOSINOPHIL GRANULE PROTEIN / EMBP | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報extracellular matrix structural constituent conferring compression resistance / defense response to nematode / negative regulation of macrophage cytokine production / negative regulation of interleukin-10 production / positive regulation of interleukin-4 production /  小胞 / 小胞 /  heparin binding / heparin binding /  carbohydrate binding / collagen-containing extracellular matrix / ficolin-1-rich granule lumen ...extracellular matrix structural constituent conferring compression resistance / defense response to nematode / negative regulation of macrophage cytokine production / negative regulation of interleukin-10 production / positive regulation of interleukin-4 production / carbohydrate binding / collagen-containing extracellular matrix / ficolin-1-rich granule lumen ...extracellular matrix structural constituent conferring compression resistance / defense response to nematode / negative regulation of macrophage cytokine production / negative regulation of interleukin-10 production / positive regulation of interleukin-4 production /  小胞 / 小胞 /  heparin binding / heparin binding /  carbohydrate binding / collagen-containing extracellular matrix / ficolin-1-rich granule lumen / defense response to bacterium / carbohydrate binding / collagen-containing extracellular matrix / ficolin-1-rich granule lumen / defense response to bacterium /  免疫応答 / Neutrophil degranulation / extracellular exosome / extracellular region 免疫応答 / Neutrophil degranulation / extracellular exosome / extracellular region類似検索 - 分子機能 | ||||||
| 生物種 |   HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å | ||||||
 データ登録者 データ登録者 | Swaminathan, G.J. / Weaver, A.J. / Loegering, D.A. / Checkel, J.L. / Leonidas, D.D. / Gleich, G.J. / Acharya, K.R. | ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2001 ジャーナル: J.Biol.Chem. / 年: 2001タイトル: Crystal Structure of the Eosinophil Major Basic Protein at 1.8A. An Atypical Lectin with a Paradigm Shift in Specificity 著者: Swaminathan, G.J. / Weaver, A.J. / Loegering, D.A. / Checkel, J.L. / Leonidas, D.D. / Gleich, G.J. / Acharya, K.R. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1h8u.cif.gz 1h8u.cif.gz | 64 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1h8u.ent.gz pdb1h8u.ent.gz | 47.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1h8u.json.gz 1h8u.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/h8/1h8u https://data.pdbj.org/pub/pdb/validation_reports/h8/1h8u ftp://data.pdbj.org/pub/pdb/validation_reports/h8/1h8u ftp://data.pdbj.org/pub/pdb/validation_reports/h8/1h8u | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  1litS S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 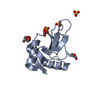
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
| ||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (0.717976, -0.022182, 0.695715), ベクター  : : |
- 要素
要素
| #1: タンパク質 | 分子量: 13820.900 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)   HOMO SAPIENS (ヒト) / Cell: EOSINOPHIL / 細胞内の位置: SECRETORY GRANULES / Organelle: PRIMARY GRANULE / 組織: BLOOD HOMO SAPIENS (ヒト) / Cell: EOSINOPHIL / 細胞内の位置: SECRETORY GRANULES / Organelle: PRIMARY GRANULE / 組織: BLOOD 血液 / 参照: UniProt: P13727 血液 / 参照: UniProt: P13727#2: 化合物 | ChemComp-SO4 /  硫酸塩 硫酸塩#3: 化合物 |  グリセリン グリセリン#4: 水 | ChemComp-HOH / |  水 水構成要素の詳細 | INVOLVED IN ANTIPARASITIC DEFENSE MECHANISMS AND IMMUNE HYPERSENSITIVITY REACTIONS. INDUCES ...INVOLVED IN ANTIPARASI | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.32 Å3/Da / 溶媒含有率: 45 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | pH: 6 詳細: 100MM MALONIC ACID PH6, 140MM POTTASIUM DIHYDROGEN PHOSPHATE., pH 6.00 | ||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 20 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  SRS SRS  / ビームライン: PX14.1 / 波長: 1.244 / ビームライン: PX14.1 / 波長: 1.244 |
| 検出器 | タイプ: ADSC CCD / 検出器: CCD / 日付: 2000年5月15日 / 詳細: MIRRORS |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1.244 Å / 相対比: 1 : 1.244 Å / 相対比: 1 |
| 反射 | 解像度: 1.8→40 Å / Num. obs: 21127 / % possible obs: 96 % / 冗長度: 10.27 % / Biso Wilson estimate: 24 Å2 / Rsym value: 0.07 / Net I/σ(I): 16.2 |
| 反射 シェル | 解像度: 1.8→1.86 Å / Mean I/σ(I) obs: 5.18 / Rsym value: 0.229 / % possible all: 91.8 |
| 反射 | *PLUS 最低解像度: 40 Å / Num. measured all: 217030 / Rmerge(I) obs: 0.07 |
| 反射 シェル | *PLUS % possible obs: 91.8 % / Rmerge(I) obs: 0.229 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: PDB ENTRY 1LIT 解像度: 1.8→36.18 Å / Rfactor Rfree error: 0.008 / Data cutoff high absF: 905624.99 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0 詳細: N-TERMINAL RESIDUES THR A1 AND CYS A2 WERE NOT SEEN IN ELECTRON DENSITY MAPS N-TERMINAL RESIDUE THR B1 WERE NOT SEEN IN ELECTRON DENSITY MAPS. NO SIDE CHAIN DENSITY SEEN FOR RESIDUES ARG B3 ...詳細: N-TERMINAL RESIDUES THR A1 AND CYS A2 WERE NOT SEEN IN ELECTRON DENSITY MAPS N-TERMINAL RESIDUE THR B1 WERE NOT SEEN IN ELECTRON DENSITY MAPS. NO SIDE CHAIN DENSITY SEEN FOR RESIDUES ARG B3 AND ARG B98 WHICH WERE MODELED AS ALANINES IN THE FINAL STRUCTURE.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 52.0733 Å2 / ksol: 0.386404 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 27.1 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.8→36.18 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.8→1.91 Å / Rfactor Rfree error: 0.031 / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: CNS / バージョン: 1 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | *PLUS Rfactor Rwork: 0.36 |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj









