+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9528 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of RyR2 in closed state | |||||||||
 マップデータ マップデータ | close state | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Membrane protein (膜タンパク質) / Channel / Membrane protein (膜タンパク質) / Channel /  TRANSPORT PROTEIN (運搬体タンパク質) TRANSPORT PROTEIN (運搬体タンパク質) | |||||||||
| 生物種 |   Sus scrofa (ブタ) Sus scrofa (ブタ) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.4 Å クライオ電子顕微鏡法 / 解像度: 4.4 Å | |||||||||
 データ登録者 データ登録者 | Peng W / Wu JP | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Science / 年: 2016 ジャーナル: Science / 年: 2016タイトル: Structural basis for the gating mechanism of the type 2 ryanodine receptor RyR2. 著者: Wei Peng / Huaizong Shen / Jianping Wu / Wenting Guo / Xiaojing Pan / Ruiwu Wang / S R Wayne Chen / Nieng Yan /   要旨: RyR2 is a high-conductance intracellular calcium (Ca) channel that controls the release of Ca from the sarco(endo)plasmic reticulum of a variety of cells. Here, we report the structures of RyR2 from ...RyR2 is a high-conductance intracellular calcium (Ca) channel that controls the release of Ca from the sarco(endo)plasmic reticulum of a variety of cells. Here, we report the structures of RyR2 from porcine heart in both the open and closed states at near-atomic resolutions determined using single-particle electron cryomicroscopy. Structural comparison reveals a breathing motion of the overall cytoplasmic region resulted from the interdomain movements of amino-terminal domains (NTDs), Helical domains, and Handle domains, whereas almost no intradomain shifts are observed in these armadillo repeats-containing domains. Outward rotations of the Central domains, which integrate the conformational changes of the cytoplasmic region, lead to the dilation of the cytoplasmic gate through coupled motions. Our structural and mutational characterizations provide important insights into the gating and disease mechanism of RyRs. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9528.map.gz emd_9528.map.gz | 502.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9528-v30.xml emd-9528-v30.xml emd-9528.xml emd-9528.xml | 18.3 KB 18.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_9528.png emd_9528.png | 78.1 KB | ||
| マスクデータ |  emd_9528_msk_1.map emd_9528_msk_1.map | 536.4 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-9528.cif.gz emd-9528.cif.gz | 8.6 KB | ||
| その他 |  emd_9528_additional.map.gz emd_9528_additional.map.gz | 495.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9528 http://ftp.pdbj.org/pub/emdb/structures/EMD-9528 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9528 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9528 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9528.map.gz / 形式: CCP4 / 大きさ: 536.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9528.map.gz / 形式: CCP4 / 大きさ: 536.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | close state | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
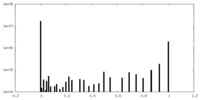
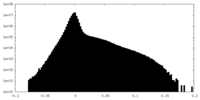
| ファイル |  emd_9528_msk_1.map emd_9528_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: #1
| ファイル | emd_9528_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : RyR2
| 全体 | 名称: RyR2 Ryanodine receptor 2 Ryanodine receptor 2 |
|---|---|
| 要素 |
|
-超分子 #1: RyR2
| 超分子 | 名称: RyR2 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Sus scrofa (ブタ) Sus scrofa (ブタ) |
| 分子量 | 理論値: 2.2 MDa |
-分子 #1: RyR2
| 分子 | 名称: RyR2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Sus scrofa (ブタ) Sus scrofa (ブタ) |
| 分子量 | 理論値: 564.905625 KDa |
| 配列 | 文字列: MADGGEGEDE IQFLRTDDEV VLQCTATIHK EQQKLCLAAE GFGNRLCFLE STSNSKNVPP DLSICTFVLE QSLSVRALQE MLANTVEKS EGQVDVEKWK FMMKTAQGGG HRTLLYGHAI LLRHSYSGMY LCCLSTSRSS TDKLAFDVGL QEDTTGEACW W TIHPASKQ ...文字列: MADGGEGEDE IQFLRTDDEV VLQCTATIHK EQQKLCLAAE GFGNRLCFLE STSNSKNVPP DLSICTFVLE QSLSVRALQE MLANTVEKS EGQVDVEKWK FMMKTAQGGG HRTLLYGHAI LLRHSYSGMY LCCLSTSRSS TDKLAFDVGL QEDTTGEACW W TIHPASKQ RSEGEKVRVG DDLILVSVSS ERYLHLSYGN VSLHVDAAFQ QTLWSVAPIS SGSEAAQGYL IGGDVLRLLH GH MDECLTV PSGEHGEEQR RTVHYEGGAV SVHARSLWRL ETLRVAWSGS HIRWGQPFRL RHVTTGKYLS LMEDKSLLLM DKE KADVKS TAFTFRSSKE KLDVGVRKEV DGMGTSEIKY GDSVCFIQHI GTGLWLTYQS VDVKSVRMGS IQRKAIMHHE GHMD DGLNL SRSQHEESRT ARVIRSTVFL FNRFIRGLDA LSKKAKASTV DLPIESVSLS LQDLIGYFHP PDEHLEHEDK QNRLR ALKN RQNLFQEEGM INLVLECIDR LHVYSSAAHF ADVAGREAGE SWKSILNSLY ELLAALIRGN RKNCAQFSGS LDWLIS RLE RLEASSGILE VLHCVLVESP EALNIIKEGH IKSIISLLDK HGRNHKVLDV LCSLCVCHGV AVRSNQHLIC DNLLPGR DL LLQTRLVNHV SSMRPNIFLG VSEGSAQYKK WYYELMVDHT EPFVTAEATH LRVGWASTEG YSPYPGGGEE WGGNGVGD D LFSYGFDGLH LWSGCIARTV SSPNQHLLRT DDVISCCLDL SAPSISFRIN GQPVQGMFEN FNIDGLFFPV VSFSAGIKV RFLLGGRHGE FKFLPPPGYA PCYEAVLPKE KLKVEHSREY KQERTYTRDL LGPTVSLTQA AFTPIPVDTS QIVLPPHLER IREKLAENI HELWVMNKIE LGWQYGPVRD DNKRQHPCLV EFSKLPEQER NYNLQMSLET LKTLLALGCH VGISDEHAEE K VKKMKLPK NYQLTSGYKP APMDLSFIKL TPSQEAMVDK LAENAHNVWA RDRIRQGWTY GIQQDVKNRR NPRLVPYALL DD RTKKSNK DSLREAVRTL LGYGYNLEAP DQDHAARAEV CSGTGERFRI FRAEKTYAVK AGRWYFEFEA VTAGDMRVGW SRP GCQPDQ ELGSDERAFA FDGFKAQRWH QGNEHYGRSW QAGDVVGCMV DMTEHTMMFT LNGEILLDDS GSELAFKDFD VGDG FIPVC SLGVAQVGRM NFGKDVSTLK YFTICGLQEG YEPFAVNTNR DITMWLSKRL PQFLQVPSSH EHIEVTRIDG TIDSS PCLK VTQKSFGSQN SSTDIMFYRL SMPIECAEVF SKTSAGGIPG ASLFGPKNDL EDYDADSDFE VLMKTAHGHL VPDRVD KDK EATKPEFNNH KDYAQEKPSR LKQRFLLRRT KPDYSTSHSA RLTEDVLADD RDDYDYLMQT STYYYSVRIF PGQEPAN VW VGWITSDFHQ YDTAFDLDRV RTVTVTLGDE KGKVHESIKR SNCYMVCAGE SMSPGQGRNN NGLEIGCVVD AASGLLTF T ANGKDLSTYY QVEPSTKLFP AVFAQATSPN VFQFELGRIK NVMPLSAGLF KSEHKNPVPQ CPPRLHVQFL SHVLWSRMP NQFLKVDVSR ISERQGWLVQ CLEPLQFMSL HIPEENRSVD ILELTEQEEL LKFHYHTLRL YSAVCALGNH RVAHALCSHV DEPQLLYAI ENKYMPGLLR AGYYDLLIDI HLSSYATARL MMNNEFIVPM TEETKSITLF PDENKKHGLP GIGLSTSLRP R MQFSSPSF VSINNECYQY SPEFPLDILK AKTIQMLTEA VQEGSLHARD PVGGTTEFLF VPLIKLFYTL LIMGIFHNED LK HILQLIE PSVFKEAAGP EEESDTLEKE PCASEDSRLE GPAEEESKGG KRPKEGLLQM KLPEPVKLQM CLLLQYLCDC QVR HRIEAI VAFSDDFVAK LQDNQRFRYN EVMQALNMSA ALTARKTKEF RSPPQEQINM LLNFKDDKSE CPCPEEIRDQ LLDF HEDLM THCGIELDED GSLDGNSDLT IRGRLLSLVE KVTYLKKKQA EKLVESDSKK SSTLQQLISE TMVRWAQESV IEDPE LVRA MFVLLHRQYD GIGGLVRALP KTYTINGVSV EDTINLLASL GQIRSLLSVR MGKEEEKLMI RGLGDIMNNK VFYQHP NLM RALGMHETVM EVMVNVLGGG ESKEITFPKM VANCCRFLCY FCRISRQNQK AMFDHLSYLL ENSSVGLASP AMRGSTP LD VAAASVMDNN ELALALREPD LEKVVRYLAG CGLQSCQMLV SKGYPDIGWN PVEGERYLDF LRFAVFCNGE SVEENANV V VRLLIRRPEC FGPALRGEGG NGLLAAMEEA IKIAEDPSRD GPSPTSGSSK MPDTEGEEDD TIHMGNAIMT FYAALIDLL GRCAPEMHLI HAAKGEAIRI RSILRSLIPL GDLVGVISIA FQMPTIAKDG NVVEPDMSAG FCPDHKAAMV LFLDRVYGIE VQDFLLHLL EVGFLPDLRA AASLDTAALS ATDMALALNR YLCTAVLPLL TRCAPLFAGT EHHASLIDSL LHTVYRLSKG C SLTKAQRD SIEVCLLSIC GQLRPSMMQH LLRRLVFDVP LLNEHAKMPL KLLTNHYERC WKYYCLPGGW GNFGAASEEE LH LSRKLFW GIFDALSQKK YEQELFKLAL PCLSAVAGAL PPDYMESNYV SMMEKQSSMD SEGNFNPQPV DTSNITIPEK LEY FINKYA EHSHDKWSMD KLANGWIYGE IYSDSSKVQP LMKPYKLLSE KEKEIYRWPI KESLKTMLAW GWRIERTREG DSMA LYNRT RRISQTSQVS VDAAHGYSPR AIDMSNVTLS RDLHAMAEMM AENYHNIWAK KKKLELESKG GGNHPLLVPY DTLTA KEKA KDREKAQDIL KFLQINGYAV SRGFKDLELD TPSIEKRFAY SFLQQLIRYV DEAHQYILEF DGGSRSKGEH FPYEQE IKF FAKVVLPLID QYFKNHRLYF LSAASRPLCS GGHASNKEKE MVTSLFCKLG VLVRHRISLF GNDATSIVNC LHILGQT LD ARTVMKTGLE SVKSALRAFL DNAAEDLEKT MENLKQGQFT HTRNQPKGVT QIINYTTVAL LPMLSSLFEH IGQHQFGE D LILEDVQVSC YRILTSLYAL GTSKSIYVER QRSALGECLA AFAGAFPVAF LETHLDKHNI YSIYNTKSSR ERAALNLPT NVEDVCPNIP SLEKLMEEIV DLAESGIRYT QMPHVMEVVL PMLCSYMSRW WEHGPENNPG RAEMCCTALN SEHMNTLLGN ILKIIYNNL GIDEGAWMKR LAVFSQPIIN KVKPQLLKTH FLPLMEKLKK KAAMVVSEED HLKSEVRGDM SEAELLILDE F TTLARDLY AFYPLLIRFV DYNRAKWLKE PNPEAEDLFR MVAEVFIYWS KSHNFKREEQ NFVVQNEINN MSFLITDTKS KM SKAAVSD QERKKMKRKG DRYSMQTSLI VAALKRLLPI GLNICAPGDQ ELIALAKNRF SLKDTEDEVR DIIRSNIHLQ GKL EDPAIR WQMALYKDLP NRTEDTSDPE KTVERVLDIA NVLFHLEQKS TCMRRRYYSL VEHPQRSKKA VWHKLLSKQR KRAV VACFR MAPLYNLPRH RAVNLFLQGY EKSWIETEEH YFEDKLIEDL AKPGAVPPEE DEGTKRVDPL HQLILLFSRT ALTEK CKLE EDFLYMAYAD IMAKSCHDEE DDDGEEEVKS FEEKEMEKQK LLYQQARLHD RGAAEMVLQT ISASKGETGP MVAATL KLG IAILNGGNST VQQKMLEYLK EKKDVGFFQS LAGLMQSCSV LDLNAFERQN KAEGLGMVTE EGSGEKVLQD DEFTCDL FR FLQLLCEGHN SDFQNYLRTQ TGNNTTVNII ISTVDYLLRV QESISDFYWY YSGKDVIDEQ GQRNFSKAIQ VAKQVFNT L TEYIQGPCTG NQQSLAHSRL WDAVVGFLHV FAHMQMKLSQ DSSQIELLKE LMDLQKDMVV MLLSMLEGNV VNGTIGKQM VDMLVESSNN VEMILKFFDM FLKLKDLTSS DTFKEYDPDG KGVISKRDFH KAMESHKHYT QSETEFLLSC AETDENETLD YEEFVKRFH EPAKDIGFNV AVLLTNLSEH MPNDTRLQTF LELAESVLNY FQPFLGRIEI MGSAKRIERV YFEISESSRT Q WEKPQVKE SKRQFIFDVV NEGGEKEKME LFVNFCEDTI FEMQLAAQIS ESDLNERSAN KEESEKEKPE EQGPRMGFFS LV TVRSALL ALRYNVLTLM RMLSLKSLKK QMKKVKKMTV RDMVTAFFTS YWSVFMTLLH FAASVSRGFS RIIGGLLLGG SLV EGAKKI KVAELLANMP DPTQDEVRGD GDEGERKVLE GTLPSEDLTD LKELTEESDL LSDIFGLDLK REGGQYKLIP HNPN AGLSD LMSSPAPIPE VQEKFQEQKA KEEEKEEKEE NKSEPEKAEG EDGEKEEKAK EDKGKQKLRQ LHTHRYGEPE VPESA FWKK IIAYQQKLLN YFARNFYNMR MLALFVAFAI NFILLFYKVS TSSVVEGKEL PTRSSSENAN FGSLDSSSPR IIAVHY VLE ESSGYMEPTL RILAILHTVI SFFCIIGYYC LKVPLVIFKR EKEVARKLEF DGLYITEQPS EDDIKGQWDR LVINTQS FP NNYWDKFVKR KVMDKYGEFY GRDRISELLG MDKAALDFSD AREKKKPKKD SSLSAVLNSI DVKYQMWKLG VVFTDNSF L YLAWYMTMSV LGHYNNFFFA AHLLDIAMGF KTLRTILSSV THNGKQLVLT VGLLAVVVYL YTVVAFNFFR KFYNKSEDG DTPDMKCDDM LTCYMFHMYV GVRAGGGIGD EIEDPAGDEY EIYRIIFDIT FFFFVIVILL AIIQGLIIDA FGELRDQQEQ VKEDMETKC FICGIGNDYF DTVPHGFETH TLQEHNLANY LFFLMYLINK DETEHTGQES YVWKMYQERC WEFFPAGDCF R KQYEDQLN |
-分子 #2: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 2 / コピー数: 4 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 詳細: 25 mM Tris, pH 7.5, 300 mM NaCl, 0.1 % Digitonin, 2 mM DTT, 5mM EDTA, and protease inhibitors. |
| グリッド | モデル: Zhongjingkeyi Technology / 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 281 K / 装置: FEI VITROBOT MARK IV 詳細: Grids were immediately blotted for 1.5 s and flash-frozen in liquid ethane. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm Bright-field microscopy / Cs: 2.7 mm |
| 撮影 | フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 検出モード: INTEGRATING / 平均電子線量: 44.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: EMDB MAP EMDB ID: |
|---|---|
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 3次元分類 | ソフトウェア - 名称: RELION (ver. 1.4) |
| 最終 角度割当 | タイプ: PROJECTION MATCHING |
| 最終 再構成 | 想定した対称性 - 点群: C4 (4回回転対称 ) / 解像度のタイプ: BY AUTHOR / 解像度: 4.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 1.4) / 使用した粒子像数: 48454 ) / 解像度のタイプ: BY AUTHOR / 解像度: 4.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 1.4) / 使用した粒子像数: 48454 |
-原子モデル構築 1
| 精密化 | 空間: RECIPROCAL |
|---|---|
| 得られたモデル |  PDB-5go9: |
 ムービー
ムービー コントローラー
コントローラー













 Z
Z Y
Y X
X