+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Complete auto-inhibitory complex of Xenopus laevis DNA polymerase alpha-primase | ||||||||||||
 マップデータ マップデータ | Complete auto-inhibitory complex of Xenopus laevis DNA polymerase alpha-primase | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード |  Primase (DNAプライマーゼ) / Primase (DNAプライマーゼ) /  DNA polymerase (DNAポリメラーゼ) / chimeric RNA-DNA primer / RNA/DNA hybrid / DNA polymerase (DNAポリメラーゼ) / chimeric RNA-DNA primer / RNA/DNA hybrid /  DNA replication (DNA複製) / DNA replication (DNA複製) /  DNA synthesis (DNA合成) / DNA synthesis (DNA合成) /  REPLICATION (DNA複製) / REPLICATION (DNA複製) /  TRANSFERASE (転移酵素) TRANSFERASE (転移酵素) | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報alpha DNA polymerase:primase complex /  DNA primase activity / lagging strand elongation / mitotic DNA replication initiation / DNA primase activity / lagging strand elongation / mitotic DNA replication initiation /  DNA replication, synthesis of primer / DNA strand elongation involved in DNA replication / leading strand elongation / DNA replication initiation / DNA replication, synthesis of primer / DNA strand elongation involved in DNA replication / leading strand elongation / DNA replication initiation /  DNA-directed RNA polymerase complex / DNA-directed RNA polymerase complex /  nuclear matrix ...alpha DNA polymerase:primase complex / nuclear matrix ...alpha DNA polymerase:primase complex /  DNA primase activity / lagging strand elongation / mitotic DNA replication initiation / DNA primase activity / lagging strand elongation / mitotic DNA replication initiation /  DNA replication, synthesis of primer / DNA strand elongation involved in DNA replication / leading strand elongation / DNA replication initiation / DNA replication, synthesis of primer / DNA strand elongation involved in DNA replication / leading strand elongation / DNA replication initiation /  DNA-directed RNA polymerase complex / DNA-directed RNA polymerase complex /  nuclear matrix / double-strand break repair via nonhomologous end joining / nuclear matrix / double-strand break repair via nonhomologous end joining /  転移酵素; リンを含む基を移すもの; 核酸を移すもの / 転移酵素; リンを含む基を移すもの; 核酸を移すもの /  核膜 / 4 iron, 4 sulfur cluster binding / 核膜 / 4 iron, 4 sulfur cluster binding /  DNA複製 / DNA複製 /  DNAポリメラーゼ / DNAポリメラーゼ /  DNA-directed DNA polymerase activity / DNA-directed DNA polymerase activity /  nucleotide binding / nucleotide binding /  chromatin binding / chromatin binding /  クロマチン / クロマチン /  核小体 / 核小体 /  DNA binding / DNA binding /  核質 / 核質 /  metal ion binding / metal ion binding /  細胞核 細胞核類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Xenopus laevis (アフリカツメガエル) Xenopus laevis (アフリカツメガエル) | ||||||||||||
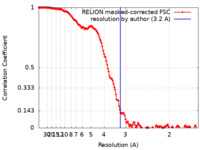
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.2 Å クライオ電子顕微鏡法 / 解像度: 3.2 Å | ||||||||||||
 データ登録者 データ登録者 | Mullins EA / Chazin WJ / Eichman BF | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: bioRxiv / 年: 2023 ジャーナル: bioRxiv / 年: 2023タイトル: A mechanistic model of primer synthesis from catalytic structures of DNA polymerase α-primase. 著者: Elwood A Mullins / Lauren E Salay / Clarissa L Durie / Noah P Bradley / Jane E Jackman / Melanie D Ohi / Walter J Chazin / Brandt F Eichman 要旨: The mechanism by which polymerase α-primase (polα-primase) synthesizes chimeric RNA-DNA primers of defined length and composition, necessary for replication fidelity and genome stability, is ...The mechanism by which polymerase α-primase (polα-primase) synthesizes chimeric RNA-DNA primers of defined length and composition, necessary for replication fidelity and genome stability, is unknown. Here, we report cryo-EM structures of polα-primase in complex with primed templates representing various stages of DNA synthesis. Our data show how interaction of the primase regulatory subunit with the primer 5'-end facilitates handoff of the primer to polα and increases polα processivity, thereby regulating both RNA and DNA composition. The structures detail how flexibility within the heterotetramer enables synthesis across two active sites and provide evidence that termination of DNA synthesis is facilitated by reduction of polα and primase affinities for the varied conformations along the chimeric primer/template duplex. Together, these findings elucidate a critical catalytic step in replication initiation and provide a comprehensive model for primer synthesis by polα-primase. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29864.map.gz emd_29864.map.gz | 193.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29864-v30.xml emd-29864-v30.xml emd-29864.xml emd-29864.xml | 29 KB 29 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29864_fsc.xml emd_29864_fsc.xml | 14.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29864.png emd_29864.png | 32.7 KB | ||
| Filedesc metadata |  emd-29864.cif.gz emd-29864.cif.gz | 8.2 KB | ||
| その他 |  emd_29864_additional_1.map.gz emd_29864_additional_1.map.gz emd_29864_half_map_1.map.gz emd_29864_half_map_1.map.gz emd_29864_half_map_2.map.gz emd_29864_half_map_2.map.gz | 204.5 MB 194 MB 194.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29864 http://ftp.pdbj.org/pub/emdb/structures/EMD-29864 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29864 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29864 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8g9fMC  8g99C  8g9lC  8g9nC  8g9oC  8ucuC  8ucvC  8ucwC  8v5mC  8v5nC  8v5oC  8v6gC  8v6hC  8v6iC  8v6jC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29864.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29864.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Complete auto-inhibitory complex of Xenopus laevis DNA polymerase alpha-primase | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.82 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Complete auto-inhibitory complex of Xenopus laevis DNA polymerase...
| ファイル | emd_29864_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Complete auto-inhibitory complex of Xenopus laevis DNA polymerase alpha-primase (locally sharpened) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Complete auto-inhibitory complex of Xenopus laevis DNA polymerase...
| ファイル | emd_29864_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Complete auto-inhibitory complex of Xenopus laevis DNA polymerase alpha-primase (half 1) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Complete auto-inhibitory complex of Xenopus laevis DNA polymerase...
| ファイル | emd_29864_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Complete auto-inhibitory complex of Xenopus laevis DNA polymerase alpha-primase (half 2) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Polymerase alpha-primase
| 全体 | 名称: Polymerase alpha-primase |
|---|---|
| 要素 |
|
-超分子 #1: Polymerase alpha-primase
| 超分子 | 名称: Polymerase alpha-primase / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 / 詳細: Heterotetrameric protein complex |
|---|---|
| 分子量 | 理論値: 110 KDa |
-超分子 #2: Polymerase alpha
| 超分子 | 名称: Polymerase alpha / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1-#2 / 詳細: Heterodimer consisting of POLA1 and POLA2 |
|---|---|
| 由来(天然) | 生物種:  Xenopus laevis (アフリカツメガエル) Xenopus laevis (アフリカツメガエル) |
| 分子量 | 理論値: 200 KDa |
-超分子 #3: Primase
| 超分子 | 名称: Primase / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #3-#4 / 詳細: Heterodimer consisting of PRIM1 and PRIM2 |
|---|---|
| 由来(天然) | 生物種:  Xenopus laevis (アフリカツメガエル) Xenopus laevis (アフリカツメガエル) |
-分子 #1: DNA polymerase alpha catalytic subunit
| 分子 | 名称: DNA polymerase alpha catalytic subunit / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号:  DNAポリメラーゼ DNAポリメラーゼ |
|---|---|
| 由来(天然) | 生物種:  Xenopus laevis (アフリカツメガエル) Xenopus laevis (アフリカツメガエル) |
| 分子量 | 理論値: 129.009414 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: SNAADGSQVF RFYWLDAYED QYSQPGVVYL FGKVWIESAD AYVSCCVSVK NIERTVYLLP RENRVQLSTG KDTGAPVSMM HVYQEFNEA VAEKYKIMKF KSKKVDKDYA FEIPDVPASS EYLEVRYSAD SPQLPQDLKG ETFSHVFGTN TSSLELFLLS R KIKGPSWL ...文字列: SNAADGSQVF RFYWLDAYED QYSQPGVVYL FGKVWIESAD AYVSCCVSVK NIERTVYLLP RENRVQLSTG KDTGAPVSMM HVYQEFNEA VAEKYKIMKF KSKKVDKDYA FEIPDVPASS EYLEVRYSAD SPQLPQDLKG ETFSHVFGTN TSSLELFLLS R KIKGPSWL EIKSPQLSSQ PMSWCKVEAV VTRPDQVSVV KDLAPPPVVV LSLSMKTVQN AKTHQNEIVA IAALVHHTFP LD KAPPQPP FQTHFCVLSK LNDCIFPYDY NEAVKQKNAN IEIALTERTL LGFFLAKIHK IDPDVIVGHD IYGFDLEVLL QRI NSCKVP FWSKIGRLRR SVMPKLGGRS GFAERNAACG RIICDIEISA KELIRCKSYH LSELVHQILK AERVVIPPEN IRNA YNDSV HLLYMLENTW IDAKFILQIM CELNVLPLAL QITNIAGNVM SRTLMGGRSE RNEYLLLHAF TENNFIVPDK PVFKK MQQT TVEDNDDMGT DQNKNKSRKK AAYAGGLVLE PKVGFYDKFI LLLDFNSLYP SIIQEYNICF TTVHREAPST QKGEDQ DEI PELPHSDLEM GILPREIRKL VERRRHVKQL MKQPDLNPDL YLQYDIRQKA LKLTANSMYG CLGFSYSRFY AKPLAAL VT HQGREILLHT KEMVQKMNLE VIYGDTDSIM INTNCNNLEE VFKLGNRVKS EINKSYKLLE IDIDGIFKSL LLLKKKKY A ALTVEPTGDG KYVTKQELKG LDIVRRDWCE LAKQAGNYVI SQILSDQPRD SIVENIQKKL TEIGENVTNG TVPITQYEI NKALTKDPQD YPDKKSLPHV HVALWINSQG GRKVKAGDTI SYVICQDGSN LSASQRAYAQ EQLQKQENLS IDTQYYLSQQ VHPVVARIC EPIDGIDSAL IAMWLGLDPS QFRAHRHYQQ DEENDALLGG PSQLTDEEKY RDCERFKFFC PKCGTENIYD N VFDGSGLQ IEPGLKRCSK PECDASPLDY VIQVHNKLLL DIRRYIKKYY SGWLVCEEKT CQNRTRRLPL SFSRNGPICQ AC SKATLRS EYPEKALYTQ LCFYRFIFDW DYALEKVVSE QERGHLKKKL FQESENQYKK LKSTVDQVLS RSGYSEVNLS KLF QTLNTI K UniProtKB: DNA polymerase alpha catalytic subunit |
-分子 #2: DNA polymerase alpha subunit B
| 分子 | 名称: DNA polymerase alpha subunit B / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Xenopus laevis (アフリカツメガエル) Xenopus laevis (アフリカツメガエル) |
| 分子量 | 理論値: 67.194219 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: SNAMSVSAKS IAEELKVFDV NFEDEEVPEK MVELCTVHRL KEEDMVNEWM AFSTTRNLPL TVGNLNLLEH EVLNKKSARP RPSLKKEKH CGNRDFNTIQ ELIEVETAEE NLLDSYATPA KGSQKRNLST PEHPQSKRIL SINRSPHVLF SPTSFSPSAT P SQKYGSRT ...文字列: SNAMSVSAKS IAEELKVFDV NFEDEEVPEK MVELCTVHRL KEEDMVNEWM AFSTTRNLPL TVGNLNLLEH EVLNKKSARP RPSLKKEKH CGNRDFNTIQ ELIEVETAEE NLLDSYATPA KGSQKRNLST PEHPQSKRIL SINRSPHVLF SPTSFSPSAT P SQKYGSRT NRGEVVTTYG ELQGTTWNGG SGSNTNVELF TSLDEPLTKM YKFMFQKLMD IREVVSIKIE ELGASLKDHF QI DEFTSVS LPAQETVTVL GQIGCDSNGK LNSKSVILEG DREHSAGMQV PVDLSELKDY SLFPGQVVIM EGTNSTGRRF VPT KLYEGV PLPFHQPSKE FEECPQQMVI TACGPFTTSD TITYDALKDL IDIVNRDRPD ICILLGPFLD AKHEQIENLQ LTVT FEDVF KRCLKMIIEG TRPSGCHLVI VPSLRDVHHD PVYPQPPFSC FEPAKEDKER VHFVADPCTL SVNGVVIGMT STDLL FHMG AEEISSSAGA PDRFSRILRH ILTQRSYYPL YPPNEEINID YEALYSYTPM PVTPDVFIVP SELRYFIKDV TGCICI NPG RLTKGLVGGT YARFLVKSGA MGSEGKRSTC ISAQVVRV UniProtKB:  DNA polymerase alpha subunit B DNA polymerase alpha subunit B |
-分子 #3: DNA primase large subunit
| 分子 | 名称: DNA primase large subunit / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Xenopus laevis (アフリカツメガエル) Xenopus laevis (アフリカツメガエル) |
| 分子量 | 理論値: 59.673844 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MLFSRDRKYR HNTRLTGDRK GDLYPSSLQF YQHPPTENIS LIEFETFAIE RLKLLKAVEN LGVSYVKNSE EYSKKLELEL RKLKFPYRP LHEEISDDVY DLRRKDHISH FILRLAYCQS EDLRRWFIQQ EMDLFKFRFG LLTKESVQEF LKLNDLQYVA I SEDEKNMH ...文字列: MLFSRDRKYR HNTRLTGDRK GDLYPSSLQF YQHPPTENIS LIEFETFAIE RLKLLKAVEN LGVSYVKNSE EYSKKLELEL RKLKFPYRP LHEEISDDVY DLRRKDHISH FILRLAYCQS EDLRRWFIQQ EMDLFKFRFG LLTKESVQEF LKLNDLQYVA I SEDEKNMH KEDLMNSSFG LSLTKMEDTE FYKVPFQAAL DLVRPRKVFL WRGFAFIPHK DIVSIVLNDF RAKLSKALAL SA RSLPVVQ SDERLQPLLN HLSHSYIGQD FSSQSNTGKI SLEQIDGFAA KSFPLCMRQL HKSLRENHHL RHGGRMQYGL FLK GIGLTL EQALQFWRLE FTKGKVDSEK FDKVYAYSIR HNYGKEGKRT DYTPYSCMKV ILSNPPSQGD YHGCPFRHSD PELL KQKLQ SFKVPSSGIN QILELVKGMH YQLACQKYFE LTHSVDDCGF SLNHPNQYFA ESQKLLTGSR EIKKEQTARD SPAVT ASQL SSSSSSASIP KSQSSAPEME DLEQIFSEY UniProtKB:  DNA primase large subunit DNA primase large subunit |
-分子 #4: DNA primase
| 分子 | 名称: DNA primase / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Xenopus laevis (アフリカツメガエル) Xenopus laevis (アフリカツメガエル) |
| 分子量 | 理論値: 49.356387 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: GPHMDLSVYD PASLPDVLPL YYRRLFPFYQ YFRWLNYGGV VKNYFQHREF SFTLKDDVYV RYQSFNNQSE LEKEMQKMCP YKIDIGAVY SHRPSLHNTV KSGTFQAQEK ELVFDIDMTD YDDVRRCCSS ADICPKCWTL MTIAVRILDR ALAEDFGFKH R LWVYSGRR ...文字列: GPHMDLSVYD PASLPDVLPL YYRRLFPFYQ YFRWLNYGGV VKNYFQHREF SFTLKDDVYV RYQSFNNQSE LEKEMQKMCP YKIDIGAVY SHRPSLHNTV KSGTFQAQEK ELVFDIDMTD YDDVRRCCSS ADICPKCWTL MTIAVRILDR ALAEDFGFKH R LWVYSGRR GVHCWVCDDS ARKLSQAERS AVAEYLSVVK GGEETIKKVQ LPETIHPFIG KSLKMVERYF EKYALVDQDI LE NKQCWDK VIALVPEVAR ESLLREFSKA RSSVERWDKL SSCLEATGKD FRRYSNIPKE IMLQFCYPRL DVNVSKGLNH LLK SPFSVH PKTGRISVPI DCKKLDQFDP FSVPTISLIC SELDNVSKKE EDEDSAGEGE PEAKKRTRDY KRTSLAPYIK VFEQ FLDKL DQSRKGELLN KSDLKKEF UniProtKB:  DNAプライマーゼ DNAプライマーゼ |
-分子 #5: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 5 / コピー数: 3 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-分子 #6: IRON/SULFUR CLUSTER
| 分子 | 名称: IRON/SULFUR CLUSTER / タイプ: ligand / ID: 6 / コピー数: 1 / 式: SF4 |
|---|---|
| 分子量 | 理論値: 351.64 Da |
| Chemical component information |  ChemComp-FS1: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.9 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 105000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 105000 |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 17820 / 平均電子線量: 54.8 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






















 Z
Z Y
Y X
X