+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1049 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | A cellular receptor of human rhinovirus type 2, the very-low-density lipoprotein receptor, binds to two neighboring proteins of the viral capsid. | |||||||||
 マップデータ マップデータ | This is a 3D reconstruction of HRV2/MBP-VLDLR(-123) | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  Human rhinovirus 2 (ライノウイルス) Human rhinovirus 2 (ライノウイルス) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 16.0 Å | |||||||||
 データ登録者 データ登録者 | Neumann E / Moser R / Snyers L / Blaas D / Hewat EA | |||||||||
 引用 引用 |  ジャーナル: J Virol / 年: 2003 ジャーナル: J Virol / 年: 2003タイトル: A cellular receptor of human rhinovirus type 2, the very-low-density lipoprotein receptor, binds to two neighboring proteins of the viral capsid. 著者: Emmanuelle Neumann / Rosita Moser / Luc Snyers / Dieter Blaas / Elizabeth A Hewat /  要旨: The very-low-density lipoprotein receptor (VLDL-R) is a receptor for the minor-group human rhinoviruses (HRVs). Only two of the eight binding repeats of the VLDL-R bind to HRV2, and their footprints ...The very-low-density lipoprotein receptor (VLDL-R) is a receptor for the minor-group human rhinoviruses (HRVs). Only two of the eight binding repeats of the VLDL-R bind to HRV2, and their footprints describe an annulus on the dome at each fivefold axis. By studying the complex formed between a selection of soluble fragments of the VLDL-R and HRV2, we demonstrate that it is the second and third repeats that bind. We also show that artificial concatemers of the same repeat can bind to HRV2 with the same footprint as that for the native receptor. In a 16-A-resolution cryoelectron microscopy map of HRV2 in complex with the VLDL-R, the individual repeats are defined. The third repeat is strongly bound to charged and polar residues of the HI and BC loops of viral protein 1 (VP1), while the second repeat is more weakly bound to the neighboring VP1. The footprint of the strongly bound third repeat extends down the north side of the canyon. Since the receptor molecule can bind to two adjacent copies of VP1, we suggest that the bound receptor "staples" the VP1s together and must be detached before release of the RNA can occur. When the receptor is bound to neighboring sites on HRV2, steric hindrance prevents binding of the second repeat. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1049.map.gz emd_1049.map.gz | 15.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1049-v30.xml emd-1049-v30.xml emd-1049.xml emd-1049.xml | 10.5 KB 10.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  1049.gif 1049.gif | 40 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1049 http://ftp.pdbj.org/pub/emdb/structures/EMD-1049 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1049 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1049 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1049.map.gz / 形式: CCP4 / 大きさ: 30.9 MB / タイプ: IMAGE STORED AS SIGNED INTEGER (2 BYTES) ダウンロード / ファイル: emd_1049.map.gz / 形式: CCP4 / 大きさ: 30.9 MB / タイプ: IMAGE STORED AS SIGNED INTEGER (2 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | This is a 3D reconstruction of HRV2/MBP-VLDLR(-123) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.76 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
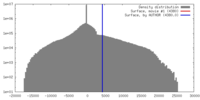
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Human Rhinovirus 2 in complex with its cellular receptor, VLDL-R
| 全体 | 名称: Human Rhinovirus 2 in complex with its cellular receptor, VLDL-R |
|---|---|
| 要素 |
|
-超分子 #1000: Human Rhinovirus 2 in complex with its cellular receptor, VLDL-R
| 超分子 | 名称: Human Rhinovirus 2 in complex with its cellular receptor, VLDL-R タイプ: sample / ID: 1000 / Number unique components: 2 |
|---|
-超分子 #1: Human rhinovirus 2
| 超分子 | 名称: Human rhinovirus 2 / タイプ: virus / ID: 1 / NCBI-ID: 12130 / 生物種: Human rhinovirus 2 / ウイルスタイプ: VIRION / ウイルス・単離状態: SEROTYPE / ウイルス・エンベロープ: No / ウイルス・中空状態: No |
|---|---|
| 宿主 | 生物種:  Homo sapiens (ヒト) / 別称: VERTEBRATES Homo sapiens (ヒト) / 別称: VERTEBRATES |
| ウイルス殻 | Shell ID: 1 / 直径: 300 Å |
-超分子 #2: Cellular Receptor
| 超分子 | 名称: Cellular Receptor / タイプ: organelle_or_cellular_component / ID: 2 / Name.synonym: Very Low Density Lipoprotein - Receptor 詳細: The VLDL-R consists of eight imperfect ligand-binding repeats of approximately 40 amino acids at its N-terminus. Recombinant VLDL-minireceptors encompassing different ligand-binding repeats ...詳細: The VLDL-R consists of eight imperfect ligand-binding repeats of approximately 40 amino acids at its N-terminus. Recombinant VLDL-minireceptors encompassing different ligand-binding repeats are here expressed with the first three repeats + a Maltose Binding Protein fused to the N-terminus + a Hexa-his-tag fused to the C-terminus. 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 組織: muscle Homo sapiens (ヒト) / 別称: Human / 組織: muscle |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.82 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: 50 mM Tris-HCl for the virus 2 mM CaCl2, 20 mM Tris-HCL for the receptor fragment |
| グリッド | 詳細: 300 mesh copper grid |
| 凍結 | 凍結剤: ETHANE / 手法: Blot with filter paper for 1-2 seconds |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 2010F |
|---|---|
| アライメント法 | Legacy - 非点収差: objective lens astigmatism was corrected at 300,000 times magnification |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: OTHER / デジタル化 - サンプリング間隔: 7 µm / 実像数: 33 / 平均電子線量: 15 e/Å2 / 詳細: Zeiss PhotoScan TD scanner |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 39700 / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / Cs: 1.4 mm / 最大 デフォーカス(公称値): 2.9 µm / 最小 デフォーカス(公称値): 1.18 µm / 倍率(公称値): 40000 |
| 試料ステージ | 試料ホルダー: Oxford cryo-holder CT3200 / 試料ホルダーモデル: OTHER |
- 画像解析
画像解析
| 詳細 | HRV2 and receptor fragment were incubated for 1 hour at 4 degree Celcius. |
|---|---|
| CTF補正 | 詳細: CTFMIX |
| 最終 再構成 | 想定した対称性 - 点群: I (正20面体型対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 16.0 Å / 解像度の算出法: FSC 0.5 CUT-OFF 詳細: Methods for reconstructing density maps of "single" particles from cryoelectron micrographs to subnanometer resolution (Conway et al.,J Struct Biol. 1999 Dec 1;128(1):106-18.) 使用した粒子像数: 912 |
-原子モデル構築 1
| ソフトウェア | 名称: O |
|---|---|
| 詳細 | Protocol: Manual docking. Fitting the X-RAY structures of HRV2 and the VLDL-R repeats to the cryo-electron microscope reconstructed density. Determination of the residues included in the footprints. |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)