+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human nucleolar pre-60S ribosomal subunit (States D1,D2 combined) - DDX54 focused map | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Pre-60S ribosomal subunit / Assembly intermediate /  Ribosome (リボソーム) / Ribosome (リボソーム) /  Nucleoprotein complex (核タンパク質) Nucleoprotein complex (核タンパク質) | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.59 Å クライオ電子顕微鏡法 / 解像度: 2.59 Å | |||||||||
 データ登録者 データ登録者 | Vanden Broeck A / Klinge S | |||||||||
| 資金援助 | European Union,  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Science / 年: 2023 ジャーナル: Science / 年: 2023タイトル: Principles of human pre-60 biogenesis. 著者: Arnaud Vanden Broeck / Sebastian Klinge /  要旨: During the early stages of human large ribosomal subunit (60) biogenesis, an ensemble of assembly factors establishes and fine-tunes the essential RNA functional centers of pre-60 particles by an ...During the early stages of human large ribosomal subunit (60) biogenesis, an ensemble of assembly factors establishes and fine-tunes the essential RNA functional centers of pre-60 particles by an unknown mechanism. Here, we report a series of cryo-electron microscopy structures of human nucleolar and nuclear pre-60 assembly intermediates at resolutions of 2.5 to 3.2 angstroms. These structures show how protein interaction hubs tether assembly factor complexes to nucleolar particles and how guanosine triphosphatases and adenosine triphosphatase couple irreversible nucleotide hydrolysis steps to the installation of functional centers. Nuclear stages highlight how a conserved RNA-processing complex, the rixosome, couples large-scale RNA conformational changes with pre-ribosomal RNA processing by the RNA degradation machinery. Our ensemble of human pre-60 particles provides a rich foundation with which to elucidate the molecular principles of ribosome formation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29162.map.gz emd_29162.map.gz | 7.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29162-v30.xml emd-29162-v30.xml emd-29162.xml emd-29162.xml | 15 KB 15 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29162_fsc.xml emd_29162_fsc.xml | 15.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29162.png emd_29162.png | 102.5 KB | ||
| マスクデータ |  emd_29162_msk_1.map emd_29162_msk_1.map | 421.9 MB |  マスクマップ マスクマップ | |
| その他 |  emd_29162_half_map_1.map.gz emd_29162_half_map_1.map.gz emd_29162_half_map_2.map.gz emd_29162_half_map_2.map.gz | 392 MB 392 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29162 http://ftp.pdbj.org/pub/emdb/structures/EMD-29162 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29162 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29162 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8fkpC  8fkqC  8fkrC  8fksC  8fktC  8fkuC  8fkvC  8fkwC  8fkxC  8fkyC  8fkzC  8fl0C  8fl2C  8fl3C  8fl4C  8fl6C  8fl7C  8fl9C  8flaC  8flbC  8flcC  8fldC  8fleC  8flfC C: 同じ文献を引用 ( |
|---|
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29162.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29162.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.072 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_29162_msk_1.map emd_29162_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
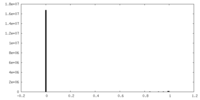
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_29162_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
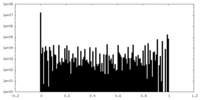
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_29162_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
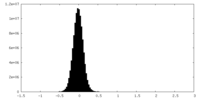
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human nucleolar pre-60S ribosomal subunit
| 全体 | 名称: Human nucleolar pre-60S ribosomal subunit |
|---|---|
| 要素 |
|
-超分子 #1: Human nucleolar pre-60S ribosomal subunit
| 超分子 | 名称: Human nucleolar pre-60S ribosomal subunit / タイプ: complex / ID: 1 / 親要素: 0 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) / 株: HEK293F Homo sapiens (ヒト) / 株: HEK293F |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.6 |
|---|---|
| グリッド | モデル: Quantifoil R3.5/1 / 材質: GOLD / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 支持フィルム - Film thickness: 2 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 283 K / 装置: FEI VITROBOT MARK IV 詳細: Four applications with manual blotting before last blotting with the vitrobot.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 64000 Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 64000 |
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 4 / 実像数: 172699 / 平均露光時間: 2.0 sec. / 平均電子線量: 60.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






























































































































 Z
Z Y
Y X
X