+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10430 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Mouse RNF213 mutant R4753K modeling the Moyamoya-disease-related Human variant R4810K | |||||||||
 マップデータ マップデータ | Composite map assembled from 4 focused refinements | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報lipid ubiquitination / lipid droplet formation / negative regulation of non-canonical Wnt signaling pathway /  xenophagy / Antigen processing: Ubiquitination & Proteasome degradation / xenophagy / Antigen processing: Ubiquitination & Proteasome degradation /  転移酵素; アシル基を移すもの; アミノアシル基を移すもの / 転移酵素; アシル基を移すもの; アミノアシル基を移すもの /  血管新生 / 血管新生 /  immune system process / protein K63-linked ubiquitination / regulation of lipid metabolic process ...lipid ubiquitination / lipid droplet formation / negative regulation of non-canonical Wnt signaling pathway / immune system process / protein K63-linked ubiquitination / regulation of lipid metabolic process ...lipid ubiquitination / lipid droplet formation / negative regulation of non-canonical Wnt signaling pathway /  xenophagy / Antigen processing: Ubiquitination & Proteasome degradation / xenophagy / Antigen processing: Ubiquitination & Proteasome degradation /  転移酵素; アシル基を移すもの; アミノアシル基を移すもの / 転移酵素; アシル基を移すもの; アミノアシル基を移すもの /  血管新生 / 血管新生 /  immune system process / protein K63-linked ubiquitination / regulation of lipid metabolic process / protein autoubiquitination / immune system process / protein K63-linked ubiquitination / regulation of lipid metabolic process / protein autoubiquitination /  lipid droplet / lipid droplet /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / RING-type E3 ubiquitin transferase / ubiquitin-protein transferase activity / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / RING-type E3 ubiquitin transferase / ubiquitin-protein transferase activity /  ubiquitin protein ligase activity / ubiquitin-dependent protein catabolic process / ubiquitin protein ligase activity / ubiquitin-dependent protein catabolic process /  血管新生 / protein ubiquitination / defense response to bacterium / 血管新生 / protein ubiquitination / defense response to bacterium /  核小体 / 核小体 /  ATP hydrolysis activity / ATP hydrolysis activity /  ATP binding / ATP binding /  metal ion binding / metal ion binding /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.2 Å クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Ahel J / Meinhart A / Haselbach D / Clausen T | |||||||||
| 資金援助 |  オーストリア, 1件 オーストリア, 1件
| |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2020 ジャーナル: Elife / 年: 2020タイトル: Moyamoya disease factor RNF213 is a giant E3 ligase with a dynein-like core and a distinct ubiquitin-transfer mechanism. 著者: Juraj Ahel / Anita Lehner / Antonia Vogel / Alexander Schleiffer / Anton Meinhart / David Haselbach / Tim Clausen /  要旨: RNF213 is the major susceptibility factor for Moyamoya disease, a progressive cerebrovascular disorder that often leads to brain stroke in adults and children. Characterization of disease-associated ...RNF213 is the major susceptibility factor for Moyamoya disease, a progressive cerebrovascular disorder that often leads to brain stroke in adults and children. Characterization of disease-associated mutations has been complicated by the enormous size of RNF213. Here, we present the cryo-EM structure of mouse RNF213. The structure reveals the intricate fold of the 584 kDa protein, comprising an N-terminal stalk, a dynein-like core with six ATPase units, and a multidomain E3 module. Collaboration with UbcH7, a cysteine-reactive E2, points to an unexplored ubiquitin-transfer mechanism that proceeds in a RING-independent manner. Moreover, we show that pathologic MMD mutations cluster in the composite E3 domain, likely interfering with substrate ubiquitination. In conclusion, the structure of RNF213 uncovers a distinct type of an E3 enzyme, highlighting the growing mechanistic diversity in ubiquitination cascades. Our results also provide the molecular framework for investigating the emerging role of RNF213 in lipid metabolism, hypoxia, and angiogenesis. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10430.map.gz emd_10430.map.gz | 153.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10430-v30.xml emd-10430-v30.xml emd-10430.xml emd-10430.xml | 28.4 KB 28.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_10430.png emd_10430.png | 51 KB | ||
| その他 |  emd_10430_additional_1.map.gz emd_10430_additional_1.map.gz emd_10430_additional_2.map.gz emd_10430_additional_2.map.gz emd_10430_additional_3.map.gz emd_10430_additional_3.map.gz emd_10430_additional_4.map.gz emd_10430_additional_4.map.gz | 151.5 MB 154.6 MB 153.3 MB 151.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10430 http://ftp.pdbj.org/pub/emdb/structures/EMD-10430 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10430 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10430 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6tayMC  6taxC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10334 (タイトル: Cryo-EM structure of RNF213 reveals a RING-type E3 with a dynein core and cysteine reactivity EMPIAR-10334 (タイトル: Cryo-EM structure of RNF213 reveals a RING-type E3 with a dynein core and cysteine reactivityData size: 1.9 TB Data #1: unaligned multi-frame micrographs of moyamoya variant of RNF213 (R4753K) [micrographs - multiframe] Data #2: unaligned multi-frame micrographs of wildtype RNF213 [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10430.map.gz / 形式: CCP4 / 大きさ: 166.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10430.map.gz / 形式: CCP4 / 大きさ: 166.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Composite map assembled from 4 focused refinements | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.04 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
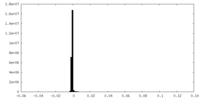
-追加マップ: None
| ファイル | emd_10430_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | None | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
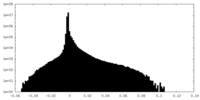
-追加マップ: focused refinement on the second half of the AAA-region
| ファイル | emd_10430_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | focused refinement on the second half of the AAA-region | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
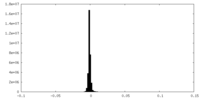
-追加マップ: None
| ファイル | emd_10430_additional_3.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | None | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
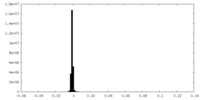
-追加マップ: focused refinement on the N-terminus
| ファイル | emd_10430_additional_4.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | focused refinement on the N-terminus | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : full length mouse RNF213 with the R4753K mutation
| 全体 | 名称: full length mouse RNF213 with the R4753K mutation |
|---|---|
| 要素 |
|
-超分子 #1: full length mouse RNF213 with the R4753K mutation
| 超分子 | 名称: full length mouse RNF213 with the R4753K mutation / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) |
| 組換発現 | 生物種:   Trichoplusia ni (イラクサキンウワバ) / 組換株: BTI-Tn-5B1-4 / 組換プラスミド: EMBacY Trichoplusia ni (イラクサキンウワバ) / 組換株: BTI-Tn-5B1-4 / 組換プラスミド: EMBacY |
| 分子量 | 実験値: 580 KDa |
-分子 #1: RNF213,E3 ubiquitin-protein ligase RNF213,E3 ubiquitin-protein li...
| 分子 | 名称: RNF213,E3 ubiquitin-protein ligase RNF213,E3 ubiquitin-protein ligase RNF213 タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: RING-type E3 ubiquitin transferase |
|---|---|
| 由来(天然) | 生物種:   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) |
| 分子量 | 理論値: 527.650312 KDa |
| 組換発現 | 生物種:   Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: (UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK) ...文字列: (UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK)(UNK)(UNK)(UNK)(UNK)(UNK) (UNK)(UNK) (UNK)KLTLGLSIL FMVEAAEFTV PKKDLDSLCY LLIPSAGSPE ALHSDLSPVL RIRQRWRIYL TNLCLR CID ERCDRWLGIL PLLHTCMQKS PPKKNSKSQP EDTWAGLEGI SFSEFRDKAP TRSQPLQFMQ SKMALLRVDE YLFRSWL SV VPLESLSSYL ENSIDYLSDV PVRVLDCLQG ISYRLPGLRK ISNQNMKKDV ENVFKMLMHL VDIYQHRIFG ENLLQIYL T ECLTLHETVC NITANHQFFE IPALSAELIC KLLELSPPGH TDEGLPEKSY EDLVTSTLQE ALATTRNWLR SLFKSRMLS ISSAYVRLTY SEEMAVWRRL VEIGFPEKHG WKGSLLGDME GRLKQEPPRL QISFFCSSQC RDGGLHDSVS RSFEKCVIEA VSSACQSQT SVLEGLSCQD LQKFGTLLSA VITKSWPVHN GEPVFDVDEI FKYLLKWPDV RQLFELCGTN EKIIDNITEE G RQLMATAE SVFQKVAGEL ENGTIVVGQL ELILEHQSQF LDIWNLNRRR LPSQEKACDV RSLLKRRRDD LLFLKQEKRY VE SLLRQLG RVKHLVQVDF GNIEIIHSQD LSNKKLNEAV IKLPNSSSYK RETHYCLSPD IREMASKLDS LKDSHIFQDF WQE TAESLN TLDKDPRELK VSLPEVLEYL YNPCYDNFYT LYENLKSGKI TFAEVDAIFK DFVDKYDELK NDLKFMCTMN PQDQ KGWIS ERVGQIKEYH TLHQAVSSAK VILQVRRALG VTGDFSVLNP LLNFADSFED FGNEKLDQIS PQFIKAKQLL QDISE PRQR CLEELARQTE LVAWLHKALE DINELKVFVD LASISAGEND IDVDRVACFH DAVQGYASLL YKMDERTNFS DFMNHL QEL WRALDNDQHL PDKLKDSARN LEWLKTVKES HGSVELSSLS LATAINSRGV YVIEAPKDGQ KISPDTVLRL LLPDGHG YP EALRTYSTEE LKELLNKLML MSGKKDHNSN TEVEKFSEVF SNMQRLVHVF IKLHCAGNML FRTWTAKVYC CPDGGIFM N FGLELLSQLT EKGDVIQLLG ALCRQMEDFL DNWKTVVAQK RAEHFYLNFY TAEQLVYLSS ELRKPRPSEA ALMMLSFIK GKCTVQDLVQ ATSACESKAD RYCLREVMKK LPQQLLSEPS LMGKLQVIMM QSLVYMSAFL PHCLDLDALG RCLAHLATMG GTPVERPLP KGLQAGQPNL ILCGHSEVLP AALAIYMQAP RQPLPTFDEV LLCTPATTIE EVELLLRRCL TSGSQGHKVY S LLFADQLS YEVGCQAEEF FQSLCTRAHR EDYQLVILCD AAREHCYIPS TFSQYKVPLV PQAPLPNIQA YLQSHYQVPK RL LSAATVF RDGLCVGIVT SERAGVGKSL YVNTLHTKLK AKLRDETVPL KIIRLTEPHL DENQVLSALL PFLKEKYQKM PVI FHIDIS TSVQTGIPIF LFKLLILQYL MDINGKIWRR SPGHLYLVEI PQGLSVQPKR SSKLNARAPL FKFLDLFPKV TCRP PKEVI DMELTPERSH TDPAMDPVEF CSEAFQRPYQ YLKRFHQQQN LDTFQYEKGS VEGSPEECLQ HFLIYCGLIN PSWSE LRNF AWFLNCQLKD CEASIFCKSA FTGDTLRGFK NFVVTFMILM ARDFATPTLH TSDQSPGRQS VTIGEVVEED LAPFSL RKR WESEPHPYVF FNGDHMTMTF IGFHLETNNN GYVDAINPSN GKVIKKDVMT KELFDGLRLQ RVPFNIDFDN LPRYEKL ER LCLALGIEWP IDPDETYELT TDNMLKILAI EMRFRCGIPV IIMGETGCGK TRLIKFLSDL KRGSVEAETM KLVKVHGG T TPSMIYSKVK EAERTAFSNK AQHKLDTILF FDEANTTEAV SCIKEILCDR TVDGEHLHED SGLHIIAACN PYRKHSQEM ILRLESAGLG YRVSAEETAD RLGSIPLRQL VYRVHALPPS LIPLVWDFGQ LNDSAEKLYI QQIVQRLVDS VSVNPSETCV IADVLSASQ MFMRKRENEC GFVSLRDVER CVKVFRWFHD HSDMLLKELD KFLHESSDST HTFERDPVLW SLVMAIGVCY H ASLEEKAS YRTAIARCFP KPYNSSRAIL DEVTHVQDLF LRGAPIRTNI ARNLALKENV FMMVICIELK IPLFLVGKPG SS KSLAKII VADAMQGQAA FSELFRCLKQ VHLVSFQCSP HSTPQGIIST FKQCARFQQG KDLGQYVSVV VLDEVGLAED SPK MPLKTL HPLLEDGCIE DDPAPYKKVG FVGISNWALD PAKMNRGIFV SRGSPNEKEL IESAEGICSS DRLVQDKIRG YFAP FAKAY ETVCQKQDKE FFGLRDYYSL IKMVFAKAKA SKRGLSPQDI THAVLRNFSG KDNIQALSIF TASLPEARYK EEVST VELI KQNIYPGPQA SSRGLDGAES RYLLVLTRNY VALQILQQTF FEGQQPEIIF GSSFPQDQEY TQICRNINRV KICMET GKM VVLLNLQNLY ESLYDALNQY YVYLGGQKYV DLGLGTHRVK CRVHTAFRLI VIEEKDVVYK QFPVPLINRL EKHYLDM NT VLQPWQKSIV QELQQWAHEF ADVKADQFIA RHKYSPADVF IGYHSDACAS VVLQAVERQG CRDLTEELYR KVSEEARS I LLDCATPDAV VRLSGSSLGS FTAKQLSQEY YYAQQHNSFV DFLQAHLRMT HHECRAVFTE ITTFSRLLTG NDCDVLASE LRGLASKPVV LSLQQYDTEY SFLKDVRSWL TNPGKRKVLV IQADFDDGTR SAQLVASAKY TAINEINKTQ GTKDFVFVYF VTKLSRMGS GTSYVGFHGG LWRSVHIDDL RRSTIMASDV TKLQNVTISQ LFKPEDKPEQ EEMEIETSQS KELAEEQMEV E DSEEMKKA SDPRSCDCSQ FLDTTRLVQS CVQGAVGMLR DQNESCARNM RRVTILLDLL NEDNTRNASF LRESKMRLHV LL NKQEENQ VRSLKEWVTR EAANQDALQE AGTFRHTLWK RVQDVVTPIL ASMIAHIDRD GNLELLAQPD SPAWVQDLWM FIY SDIKFL NISLVLNNTR SNSEMSFILV QSHMNLLKDA YNAVPFSWRI RDYLEELWVQ AQYITDTEGL SKKFVEIFQK TPLG VFLAQ FPVAQQQKLL QSYLKDFLLL TMKVSSREEL MFLQMALWSC LRELQEASGT PDETYKFPLS LPWVHLAFQH FRTRL QNFS RILTIHPQVL SSLSQAAEKH SLAGCEMTLD AFAAMACAEM LKGDLLKPSP KAWLQLVKNL STPLELVCSE GYLCDS GSM TRSVIQEVRA LWNRIFSIAL FVEHVLLGTE SHIPELSPLV TTYVSLLDKC LEEDSNLKTC RPFVAVMTTL CDCKDKA SK KFSRFGIQPC FICHGDAQDP VCLPCDHVYC LRCIQTWLIP GQMMCPYCLT DLPDKFSPTV SQDHRKAIEK HAQFRHMC N SFFVDLVSTM CFKDNTPPEK SVIDTLLSLL FVQKELLRDA SQKHREHTKS LSPFDDVVDQ TPVIRSVLLK LLLKYSFHE VKDYIQNYLT QLEKKAFLTE DKTELYLLFI SCLEDSVHQK TSAGCRNLEQ VLREEGHFLR TYSPGLQGQE PVRIASVEYL QEVARVRLC LDLAADFLSE LQEGSELAED KRRFLKHVEE FCTRVNNDWH RVYLVRKLSS QRGMEFVQSF SKQGHPCQWV F PRKVIAQQ KDHVSLMDRY LVHGNEYKAV RDATAKAVLE CKTLDIGNAL MACRSPKPQQ TAYLLLALYT EVAALYRSPN GS LHPEAKQ LEAVNKFIKE SKILSDPNIR CFARSLVDNT LPLLKIRSAN SILKGTVTEM AVHVATILLC GHNQILKPLR NLA FYPVNM ANAFLPTMPE DLLVHARTWR GLENVTWYTC PRGHPCSVGE CGRPMQESTC LDCGLPVGGL NHTPHEGFSA IRNN EDRTQ TGHVLGSPQS SGVAEVSDRG QSPVVFILTR LLTHLAMLVG ATHNPQALTV IIKPWVQDPQ GFLQQHIQRD LEQLT KMLG RSADETIHVV HLILSSLLRV QSHGVLNFNA ELSTKGCRNN WEKHFETLLL RELKHLDKNL PAINALISQD ERISSN PVT KIIYGDPATF LPHLPQKSII HCSKIWSCRR KITVEYLQHI VEQKNGKETV PVLWHFLQKE AELRLVKFLP EILALQR DL VKQFQNVSRV EYSSIKGFIH SHSSDGLRKL LHDRITIFLS TWNALRRSLE TNGEIKLPKD YCCSDLDLDA EFEVILPR R QGLGLCGTAL VSYLISLHNN MVYTVQKFSN EDNSYSVDIS EVADLHVISY EVERDLNPLI LSNCQYQVQQ GGETSQEFD LEKIQRQISS RFLQGKPRLT LKGIPTLVYR RDWNYEHLFM DIKNKMAQSS LPNLAISTIS GQLQSYSDAC EALSIIEITL GFLSTAGGD PGMDLNVYIE EVLRMCDQTA QVLKAFSRCQ LRHIIALWQF LSAHKSEQRL RLNKELFREI DVQYKEELST Q HQRLLGTF LNEAGLDAFL LELHEMIVLK LKGPRAANSF NPNWSLKDTL VSYMETKDSD ILSEVESQFP EEILMSSCIS VW KIAATRK WDRQSRGGGH HHHHHHHHH |
-分子 #2: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 1 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-分子 #3: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 3 / コピー数: 1 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #4: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.2 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: GOLD / メッシュ: 200 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 0.01 kPa 詳細: SCD 005 Sputter Coater (BAL-TEC) grid sitting on a metallic mesh during glow discharge | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 277 K / 装置: LEICA EM GP 詳細: blot for 1.5 seconds using using Whatman Filter Paper Grade 1. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 130000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 130000 |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / デジタル化 - 画像ごとのフレーム数: 1-40 / 撮影したグリッド数: 1 / 実像数: 6561 / 平均露光時間: 10.0 sec. / 平均電子線量: 47.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| CTF補正 | ソフトウェア - 名称: CTFFIND (ver. 4) |
|---|---|
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: RELION (ver. 3.0) |
| 最終 3次元分類 | クラス数: 10 / ソフトウェア - 名称: RELION (ver. 3.0) |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: RELION (ver. 3.0) |
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / アルゴリズム: FOURIER SPACE / 解像度のタイプ: BY AUTHOR / 解像度: 3.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 3.0) / 使用した粒子像数: 374000 |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-6tay: |
 ムービー
ムービー コントローラー
コントローラー














 Z
Z Y
Y X
X