+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9126 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM Structure of vanadate-trapped E.coli LptB2FGC | |||||||||
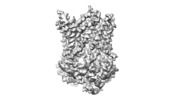
 マップデータ マップデータ | Cryo-EM map of vanadate-trapped LptB2FGC filtered to 4.3A and -240 b-factor | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  ABC transporter / ABC transporter /  lipopolysaccharide (リポ多糖) / LPS / lipopolysaccharide (リポ多糖) / LPS /  nanodisc / nanodisc /  MEMBRANE PROTEIN (膜タンパク質) / Hydrolase-Transport Protein complex MEMBRANE PROTEIN (膜タンパク質) / Hydrolase-Transport Protein complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報トランスロカーゼ; 炭水化物とその誘導体の輸送を触媒; ヌクレオシド三リン酸の加水分解を伴う /  transporter complex / lipopolysaccharide transport / Gram-negative-bacterium-type cell outer membrane assembly / ATP-binding cassette (ABC) transporter complex / transmembrane transport / transporter complex / lipopolysaccharide transport / Gram-negative-bacterium-type cell outer membrane assembly / ATP-binding cassette (ABC) transporter complex / transmembrane transport /  ATP hydrolysis activity / ATP hydrolysis activity /  ATP binding / ATP binding /  生体膜 / 生体膜 /  細胞膜 / 細胞膜 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Escherichia coli (大腸菌) / Escherichia coli (大腸菌) /   Escherichia coli (strain K12) (大腸菌) Escherichia coli (strain K12) (大腸菌) | |||||||||
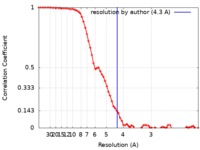
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.3 Å クライオ電子顕微鏡法 / 解像度: 4.3 Å | |||||||||
 データ登録者 データ登録者 | Orlando BJ / Li Y | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2019 ジャーナル: Nature / 年: 2019タイトル: Structural basis of lipopolysaccharide extraction by the LptBFGC complex. 著者: Yanyan Li / Benjamin J Orlando / Maofu Liao /  要旨: In Gram-negative bacteria, lipopolysaccharide is essential for outer membrane formation and antibiotic resistance. The seven lipopolysaccharide transport (Lpt) proteins A-G move lipopolysaccharide ...In Gram-negative bacteria, lipopolysaccharide is essential for outer membrane formation and antibiotic resistance. The seven lipopolysaccharide transport (Lpt) proteins A-G move lipopolysaccharide from the inner to the outer membrane. The ATP-binding cassette transporter LptBFG, which tightly associates with LptC, extracts lipopolysaccharide out of the inner membrane. The mechanism of the LptBFG-LptC complex (LptBFGC) and the role of LptC in lipopolysaccharide transport are poorly understood. Here we characterize the structures of LptBFG and LptBFGC in nucleotide-free and vanadate-trapped states, using single-particle cryo-electron microscopy. These structures resolve the bound lipopolysaccharide, reveal transporter-lipopolysaccharide interactions with side-chain details and uncover how the capture and extrusion of lipopolysaccharide are coupled to conformational rearrangements of LptBFGC. LptC inserts its transmembrane helix between the two transmembrane domains of LptBFG, which represents a previously unknown regulatory mechanism for ATP-binding cassette transporters. Our results suggest a role for LptC in achieving efficient lipopolysaccharide transport, by coordinating the action of LptBFG in the inner membrane and Lpt protein interactions in the periplasm. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9126.map.gz emd_9126.map.gz | 24.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9126-v30.xml emd-9126-v30.xml emd-9126.xml emd-9126.xml | 15.3 KB 15.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_9126_fsc.xml emd_9126_fsc.xml | 8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_9126.png emd_9126.png | 63.6 KB | ||
| Filedesc metadata |  emd-9126.cif.gz emd-9126.cif.gz | 6.2 KB | ||
| その他 |  emd_9126_additional.map.gz emd_9126_additional.map.gz | 20.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9126 http://ftp.pdbj.org/pub/emdb/structures/EMD-9126 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9126 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9126 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6mi8MC  9118C  9124C  9125C  9128C  9129C  9130C  6mhuC  6mhzC  6mi7C C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9126.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9126.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM map of vanadate-trapped LptB2FGC filtered to 4.3A and -240 b-factor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: unfiltered cryo-EM map of vanadate-trapped LptB2FGC
| ファイル | emd_9126_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | unfiltered cryo-EM map of vanadate-trapped LptB2FGC | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : LptB2FGC
| 全体 | 名称: LptB2FGC |
|---|---|
| 要素 |
|
-超分子 #1: LptB2FGC
| 超分子 | 名称: LptB2FGC / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (大腸菌) / 株: K12 Escherichia coli (大腸菌) / 株: K12 |
-分子 #1: Lipopolysaccharide export system ATP-binding protein LptB
| 分子 | 名称: Lipopolysaccharide export system ATP-binding protein LptB タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO EC番号:  加水分解酵素; 酸無水物に作用; 酸無水物に作用・物質の膜輸送を触媒する 加水分解酵素; 酸無水物に作用; 酸無水物に作用・物質の膜輸送を触媒する |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (strain K12) (大腸菌) / 株: K12 Escherichia coli (strain K12) (大腸菌) / 株: K12 |
| 分子量 | 理論値: 28.131088 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MGHHHHHHHH MATLTAKNLA KAYKGRRVVE DVSLTVNSGE IVGLLGPNGA GKTTTFYMVV GIVPRDAGNI IIDDDDISLL PLHARARRG IGYLPQEASI FRRLSVYDNL MAVLQIRDDL SAEQREDRAN ELMEEFHIEH LRDSMGQSLS GGERRRVEIA R ALAANPKF ...文字列: MGHHHHHHHH MATLTAKNLA KAYKGRRVVE DVSLTVNSGE IVGLLGPNGA GKTTTFYMVV GIVPRDAGNI IIDDDDISLL PLHARARRG IGYLPQEASI FRRLSVYDNL MAVLQIRDDL SAEQREDRAN ELMEEFHIEH LRDSMGQSLS GGERRRVEIA R ALAANPKF ILLDEPFAGV DPISVIDIKR IIEHLRDSGL GVLITDHNVR ETLAVCERAY IVSQGHLIAH GTPTEILQDE HV KRVYLGE DFRL UniProtKB: Lipopolysaccharide export system ATP-binding protein LptB |
-分子 #2: Lipopolysaccharide export system permease protein LptF
| 分子 | 名称: Lipopolysaccharide export system permease protein LptF タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (strain K12) (大腸菌) / 株: K12 Escherichia coli (strain K12) (大腸菌) / 株: K12 |
| 分子量 | 理論値: 40.393473 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MIIIRYLVRE TLKSQLAILF ILLLIFFCQK LVRILGAAVD GDIPANLVLS LLGLGVPEMA QLILPLSLFL GLLMTLGKLY TESEITVMH ACGLSKAVLV KAAMILAVFT AIVAAVNVMW AGPWSSRHQD EVLAEAKANP GMAALAQGQF QQATNGSSVL F IESVDGSD ...文字列: MIIIRYLVRE TLKSQLAILF ILLLIFFCQK LVRILGAAVD GDIPANLVLS LLGLGVPEMA QLILPLSLFL GLLMTLGKLY TESEITVMH ACGLSKAVLV KAAMILAVFT AIVAAVNVMW AGPWSSRHQD EVLAEAKANP GMAALAQGQF QQATNGSSVL F IESVDGSD FKDVFLAQIR PKGNARPSVV VADSGHLTQL RDGSQVVTLN QGTRFEGTAL LRDFRITDFQ DYQAIIGHQA VA LDPNDTD QMDMRTLWNT DTDRARAELN WRITLVFTVF MMALMVVPLS VVNPRQGRVL SMLPAMLLYL LFFLIQTSLK SNG GKGKLD PTLWMWTVNL IYLALAIVLN LWDTVPVRRL RASFSRKGAV UniProtKB: Lipopolysaccharide export system permease protein LptF |
-分子 #3: Lipopolysaccharide export system permease protein LptG
| 分子 | 名称: Lipopolysaccharide export system permease protein LptG タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Escherichia coli (strain K12) (大腸菌) / 株: K12 Escherichia coli (strain K12) (大腸菌) / 株: K12 |
| 分子量 | 理論値: 39.65141 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MQPFGVLDRY IGKTIFTTIM MTLFMLVSLS GIIKFVDQLK KAGQGSYDAL GAGMYTLLSV PKDVQIFFPM AALLGALLGL GMLAQRSEL VVMQASGFTR MQVALSVMKT AIPLVLLTMA IGEWVAPQGE QMARNYRAQA MYGGSLLSTQ QGLWAKDGNN F VYIERVKG ...文字列: MQPFGVLDRY IGKTIFTTIM MTLFMLVSLS GIIKFVDQLK KAGQGSYDAL GAGMYTLLSV PKDVQIFFPM AALLGALLGL GMLAQRSEL VVMQASGFTR MQVALSVMKT AIPLVLLTMA IGEWVAPQGE QMARNYRAQA MYGGSLLSTQ QGLWAKDGNN F VYIERVKG DEELGGISIY AFNENRRLQS VRYAATAKFD PEHKVWRLSQ VDESDLTNPK QITGSQTVSG TWKTNLTPDK LG VVALDPD ALSISGLHNY VKYLKSSGQD AGRYQLNMWS KIFQPLSVAV MMLMALSFIF GPLRSVPMGV RVVTGISFGF VFY VLDQIF GPLTLVYGIP PIIGALLPSA SFFLISLWLL MRKS UniProtKB: Lipopolysaccharide export system permease protein LptG |
-分子 #4: ADP ORTHOVANADATE
| 分子 | 名称: ADP ORTHOVANADATE / タイプ: ligand / ID: 4 / コピー数: 2 / 式: AOV |
|---|---|
| 分子量 | 理論値: 544.156 Da |
| Chemical component information | 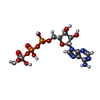 ChemComp-AOV: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | 詳細: unspecified |
| 凍結 | 凍結剤: ETHANE |
| 詳細 | nanodisc incorporated LptB2FGC |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / 平均電子線量: 45.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z
Z Y
Y X
X