+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8713 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM reconstruction of B41 SOSIP.664 in complex with soluble CD4 (D1-D2) and fragment antigen binding of 17b | |||||||||
 マップデータ マップデータ | B41 SOSIP.664 in complex with soluble CD4 (D1-D2) and fragment antigen binding variable domain of 17b | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報helper T cell enhancement of adaptive immune response /  interleukin-16 binding / interleukin-16 receptor activity / maintenance of protein location in cell / interleukin-16 binding / interleukin-16 receptor activity / maintenance of protein location in cell /  T cell selection / MHC class II protein binding / cellular response to granulocyte macrophage colony-stimulating factor stimulus / interleukin-15-mediated signaling pathway / positive regulation of monocyte differentiation / Nef Mediated CD4 Down-regulation ...helper T cell enhancement of adaptive immune response / T cell selection / MHC class II protein binding / cellular response to granulocyte macrophage colony-stimulating factor stimulus / interleukin-15-mediated signaling pathway / positive regulation of monocyte differentiation / Nef Mediated CD4 Down-regulation ...helper T cell enhancement of adaptive immune response /  interleukin-16 binding / interleukin-16 receptor activity / maintenance of protein location in cell / interleukin-16 binding / interleukin-16 receptor activity / maintenance of protein location in cell /  T cell selection / MHC class II protein binding / cellular response to granulocyte macrophage colony-stimulating factor stimulus / interleukin-15-mediated signaling pathway / positive regulation of monocyte differentiation / Nef Mediated CD4 Down-regulation / Alpha-defensins / positive regulation of kinase activity / T cell selection / MHC class II protein binding / cellular response to granulocyte macrophage colony-stimulating factor stimulus / interleukin-15-mediated signaling pathway / positive regulation of monocyte differentiation / Nef Mediated CD4 Down-regulation / Alpha-defensins / positive regulation of kinase activity /  regulation of T cell activation / regulation of T cell activation /  T cell receptor complex / extracellular matrix structural constituent / Other interleukin signaling / T cell receptor complex / extracellular matrix structural constituent / Other interleukin signaling /  enzyme-linked receptor protein signaling pathway / Translocation of ZAP-70 to Immunological synapse / Phosphorylation of CD3 and TCR zeta chains / regulation of calcium ion transport / macrophage differentiation / Generation of second messenger molecules / T cell differentiation / PD-1 signaling / positive regulation of protein kinase activity / Binding and entry of HIV virion / enzyme-linked receptor protein signaling pathway / Translocation of ZAP-70 to Immunological synapse / Phosphorylation of CD3 and TCR zeta chains / regulation of calcium ion transport / macrophage differentiation / Generation of second messenger molecules / T cell differentiation / PD-1 signaling / positive regulation of protein kinase activity / Binding and entry of HIV virion /  coreceptor activity / positive regulation of calcium-mediated signaling / positive regulation of plasma membrane raft polarization / positive regulation of receptor clustering / coreceptor activity / positive regulation of calcium-mediated signaling / positive regulation of plasma membrane raft polarization / positive regulation of receptor clustering /  protein tyrosine kinase binding / positive regulation of establishment of T cell polarity / positive regulation of interleukin-2 production / virus-mediated perturbation of host defense response / protein tyrosine kinase binding / positive regulation of establishment of T cell polarity / positive regulation of interleukin-2 production / virus-mediated perturbation of host defense response /  T細胞 / host cell endosome membrane / Vpu mediated degradation of CD4 / calcium-mediated signaling / clathrin-coated endocytic vesicle membrane / T細胞 / host cell endosome membrane / Vpu mediated degradation of CD4 / calcium-mediated signaling / clathrin-coated endocytic vesicle membrane /  cell surface receptor protein tyrosine kinase signaling pathway / positive regulation of T cell activation / positive regulation of peptidyl-tyrosine phosphorylation / transmembrane signaling receptor activity / Cargo recognition for clathrin-mediated endocytosis / Downstream TCR signaling / virus receptor activity / cell surface receptor protein tyrosine kinase signaling pathway / positive regulation of T cell activation / positive regulation of peptidyl-tyrosine phosphorylation / transmembrane signaling receptor activity / Cargo recognition for clathrin-mediated endocytosis / Downstream TCR signaling / virus receptor activity /  signaling receptor activity / MHC class II protein complex binding / signaling receptor activity / MHC class II protein complex binding /  Clathrin-mediated endocytosis / clathrin-dependent endocytosis of virus by host cell / positive regulation of canonical NF-kappaB signal transduction / defense response to Gram-negative bacterium / positive regulation of MAPK cascade / Clathrin-mediated endocytosis / clathrin-dependent endocytosis of virus by host cell / positive regulation of canonical NF-kappaB signal transduction / defense response to Gram-negative bacterium / positive regulation of MAPK cascade /  獲得免疫系 / positive regulation of viral entry into host cell / cell surface receptor signaling pathway / positive regulation of ERK1 and ERK2 cascade / 獲得免疫系 / positive regulation of viral entry into host cell / cell surface receptor signaling pathway / positive regulation of ERK1 and ERK2 cascade /  viral protein processing / viral protein processing /  エンドソーム / エンドソーム /  細胞接着 / 細胞接着 /  免疫応答 / positive regulation of protein phosphorylation / 免疫応答 / positive regulation of protein phosphorylation /  脂質ラフト / fusion of virus membrane with host plasma membrane / external side of plasma membrane / 脂質ラフト / fusion of virus membrane with host plasma membrane / external side of plasma membrane /  小胞体 / fusion of virus membrane with host endosome membrane / 小胞体 / fusion of virus membrane with host endosome membrane /  エンベロープ (ウイルス) / エンベロープ (ウイルス) /  lipid binding / endoplasmic reticulum membrane / virion attachment to host cell / lipid binding / endoplasmic reticulum membrane / virion attachment to host cell /  protein kinase binding / host cell plasma membrane / virion membrane / structural molecule activity / positive regulation of DNA-templated transcription / protein kinase binding / host cell plasma membrane / virion membrane / structural molecule activity / positive regulation of DNA-templated transcription /  enzyme binding / enzyme binding /  シグナル伝達 / protein homodimerization activity / zinc ion binding / identical protein binding / シグナル伝達 / protein homodimerization activity / zinc ion binding / identical protein binding /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||
| 生物種 |    Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) / Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) /   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
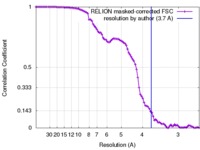
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.7 Å クライオ電子顕微鏡法 / 解像度: 3.7 Å | |||||||||
 データ登録者 データ登録者 | Pallesen J / Ozorowski G / de Val N / Ward AB | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2017 ジャーナル: Nature / 年: 2017タイトル: Open and closed structures reveal allostery and pliability in the HIV-1 envelope spike. 著者: Gabriel Ozorowski / Jesper Pallesen / Natalia de Val / Dmitry Lyumkis / Christopher A Cottrell / Jonathan L Torres / Jeffrey Copps / Robyn L Stanfield / Albert Cupo / Pavel Pugach / John P ...著者: Gabriel Ozorowski / Jesper Pallesen / Natalia de Val / Dmitry Lyumkis / Christopher A Cottrell / Jonathan L Torres / Jeffrey Copps / Robyn L Stanfield / Albert Cupo / Pavel Pugach / John P Moore / Ian A Wilson / Andrew B Ward /  要旨: For many enveloped viruses, binding to a receptor(s) on a host cell acts as the first step in a series of events culminating in fusion with the host cell membrane and transfer of genetic material for ...For many enveloped viruses, binding to a receptor(s) on a host cell acts as the first step in a series of events culminating in fusion with the host cell membrane and transfer of genetic material for replication. The envelope glycoprotein (Env) trimer on the surface of HIV is responsible for receptor binding and fusion. Although Env can tolerate a high degree of mutation in five variable regions (V1-V5), and also at N-linked glycosylation sites that contribute roughly half the mass of Env, the functional sites for recognition of receptor CD4 and co-receptor CXCR4/CCR5 are conserved and essential for viral fitness. Soluble SOSIP Env trimers are structural and antigenic mimics of the pre-fusion native, surface-presented Env, and are targets of broadly neutralizing antibodies. Thus, they are attractive immunogens for vaccine development. Here we present high-resolution cryo-electron microscopy structures of subtype B B41 SOSIP Env trimers in complex with CD4 and antibody 17b, or with antibody b12, at resolutions of 3.7 Å and 3.6 Å, respectively. We compare these to cryo-electron microscopy reconstructions of B41 SOSIP Env trimers with no ligand or in complex with either CD4 or the CD4-binding-site antibody PGV04 at 5.6 Å, 5.2 Å and 7.4 Å resolution, respectively. Consequently, we present the most complete description yet, to our knowledge, of the CD4-17b-induced intermediate and provide the molecular basis of the receptor-binding-induced conformational change required for HIV-1 entry into host cells. Both CD4 and b12 induce large, previously uncharacterized conformational rearrangements in the gp41 subunits, and the fusion peptide becomes buried in a newly formed pocket. These structures provide key details on the biological function of the type I viral fusion machine from HIV-1 as well as new templates for inhibitor design. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8713.map.gz emd_8713.map.gz | 60 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8713-v30.xml emd-8713-v30.xml emd-8713.xml emd-8713.xml | 31.1 KB 31.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_8713_fsc.xml emd_8713_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_8713.png emd_8713.png | 95.6 KB | ||
| その他 |  emd_8713_additional.map.gz emd_8713_additional.map.gz emd_8713_half_map_1.map.gz emd_8713_half_map_1.map.gz emd_8713_half_map_2.map.gz emd_8713_half_map_2.map.gz | 59.9 MB 49.6 MB 49.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8713 http://ftp.pdbj.org/pub/emdb/structures/EMD-8713 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8713 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8713 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8713.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8713.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | B41 SOSIP.664 in complex with soluble CD4 (D1-D2) and fragment antigen binding variable domain of 17b | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.31 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: B41 SOSIP.664 in complex with soluble CD4 (D1-D2)...
| ファイル | emd_8713_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | B41 SOSIP.664 in complex with soluble CD4 (D1-D2) and fragment antigen binding variable domain of 17b, additional map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
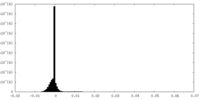
| 密度ヒストグラム |
-ハーフマップ: B41 SOSIP.664 in complex with soluble CD4 (D1-D2)...
| ファイル | emd_8713_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | B41 SOSIP.664 in complex with soluble CD4 (D1-D2) and fragment antigen binding variable domain of 17b, half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
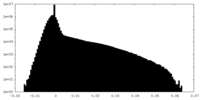
| 密度ヒストグラム |
-ハーフマップ: B41 SOSIP.664 in complex with soluble CD4 (D1-D2)...
| ファイル | emd_8713_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | B41 SOSIP.664 in complex with soluble CD4 (D1-D2) and fragment antigen binding variable domain of 17b, half-map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
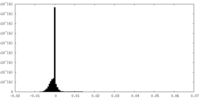
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : HIV-1 Env B41 SOSIP.664 in complex with soluble CD4 (2-domain) an...
+超分子 #1: HIV-1 Env B41 SOSIP.664 in complex with soluble CD4 (2-domain) an...
+超分子 #2: HIV-1 Env B41 SOSIP.664
+超分子 #3: CD4 (2-domain)
+超分子 #4: 17b fragment antigen
+分子 #1: 17b Fab light chain
+分子 #2: Envelope glycoprotein gp160
+分子 #3: Envelope glycoprotein gp160
+分子 #4: T-cell surface glycoprotein CD4
+分子 #5: 17b Fab heavy chain
+分子 #11: 2-acetamido-2-deoxy-beta-D-glucopyranose
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
詳細: DDM was added to a final concentration of 0.06 mM prior to vitrification | ||||||||||||
| グリッド | モデル: C-flat-2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 雰囲気: OTHER | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内温度: 277 K / 装置: HOMEMADE PLUNGER 詳細: 3 uL of sample applied to a holey carbon grid on glow discharged face and blotted manually on sample side until filter paper detached from grid, followed by immediate plunging. | ||||||||||||
| 詳細 | B41 SOSIP.664 was incubated with a 6X molar excess of soluble CD4 and 17b Fab overnight at room temperature, purified by size exclusion chromatography, and concentrated prior to grid application |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 倍率(補正後): 38168 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 22500 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 22500 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / デジタル化 - サンプリング間隔: 0.000131 µm / デジタル化 - 画像ごとのフレーム数: 1-50 / 実像数: 1169 / 平均露光時間: 10.0 sec. / 平均電子線量: 58.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 詳細 | Homology model of B41 SOSIP.664 created using PDB 5CEZ as initial model. sCD4 and 17b coordinates taken from PDB 1GC1. Performed fragment based refinement using Rosetta, followed by relaxed refinement in Rosetta. Modeled glycans using Chimera and performed final refinements using Phenix. |
|---|---|
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 当てはまり具合の基準: EMRinger |
| 得られたモデル |  PDB-5vn3: |
 ムービー
ムービー コントローラー
コントローラー



































 Z
Z Y
Y X
X