| 登録情報 | データベース: PDB / ID: 1a9z
|
|---|
| タイトル | UDP-GALACTOSE 4-EPIMERASE MUTANT S124A/Y149F COMPLEXED WITH UDP-GALACTOSE |
|---|
 要素 要素 | UDP-GALACTOSE 4-EPIMERASE |
|---|
 キーワード キーワード |  EPIMERASE / EPIMERASE /  GALACTOSE METABOLISM (ガラクトース) / GALACTOSE METABOLISM (ガラクトース) /  DEHYDROGENASE (脱水素酵素) DEHYDROGENASE (脱水素酵素) |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 |
|---|
| 生物種 |    Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
|---|
| 手法 |  X線回折 / FOURIER DIFFERENCE / 解像度: 1.9 Å X線回折 / FOURIER DIFFERENCE / 解像度: 1.9 Å |
|---|
 データ登録者 データ登録者 | Thoden, J.B. / Holden, H.M. |
|---|
 引用 引用 |  ジャーナル: Biochemistry / 年: 1998 ジャーナル: Biochemistry / 年: 1998
タイトル: Dramatic differences in the binding of UDP-galactose and UDP-glucose to UDP-galactose 4-epimerase from Escherichia coli.
著者: Thoden, J.B. / Holden, H.M. |
|---|
| 履歴 | | 登録 | 1998年4月14日 | 処理サイト: BNL |
|---|
| 改定 1.0 | 1998年10月21日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年3月3日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Derived calculations / Version format compliance |
|---|
| 改定 1.3 | 2011年11月16日 | Group: Atomic model |
|---|
| 改定 2.0 | 2021年11月3日 | Group: Atomic model / Database references ...Atomic model / Database references / Derived calculations / Other
カテゴリ: atom_site / database_2 ...atom_site / database_2 / pdbx_database_status / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site
Item: _atom_site.occupancy / _database_2.pdbx_DOI ..._atom_site.occupancy / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.process_site / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr1_symmetry / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_symmetry / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_conn.ptnr2_symmetry / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 2.1 | 2024年2月7日 | Group: Advisory / Data collection / Derived calculations
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / pdbx_struct_special_symmetry / pdbx_validate_symm_contact |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード EPIMERASE /
EPIMERASE /  GALACTOSE METABOLISM (ガラクトース) /
GALACTOSE METABOLISM (ガラクトース) /  DEHYDROGENASE (脱水素酵素)
DEHYDROGENASE (脱水素酵素) 機能・相同性情報
機能・相同性情報 UDP-ガラクトース-4-エピメラーゼ /
UDP-ガラクトース-4-エピメラーゼ /  UDP-glucose 4-epimerase activity / racemase and epimerase activity, acting on carbohydrates and derivatives / galactose catabolic process via UDP-galactose / galactose metabolic process /
UDP-glucose 4-epimerase activity / racemase and epimerase activity, acting on carbohydrates and derivatives / galactose catabolic process via UDP-galactose / galactose metabolic process /  NAD+ binding / carbohydrate metabolic process / identical protein binding /
NAD+ binding / carbohydrate metabolic process / identical protein binding /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Escherichia coli (大腸菌)
Escherichia coli (大腸菌) X線回折 / FOURIER DIFFERENCE / 解像度: 1.9 Å
X線回折 / FOURIER DIFFERENCE / 解像度: 1.9 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Biochemistry / 年: 1998
ジャーナル: Biochemistry / 年: 1998 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1a9z.cif.gz
1a9z.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1a9z.ent.gz
pdb1a9z.ent.gz PDB形式
PDB形式 1a9z.json.gz
1a9z.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/a9/1a9z
https://data.pdbj.org/pub/pdb/validation_reports/a9/1a9z ftp://data.pdbj.org/pub/pdb/validation_reports/a9/1a9z
ftp://data.pdbj.org/pub/pdb/validation_reports/a9/1a9z リンク
リンク 集合体
集合体

 要素
要素
 Escherichia coli (大腸菌) / 発現宿主:
Escherichia coli (大腸菌) / 発現宿主: 
 Escherichia coli (大腸菌)
Escherichia coli (大腸菌) UDP-ガラクトース-4-エピメラーゼ
UDP-ガラクトース-4-エピメラーゼ

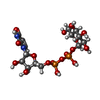





 ニコチンアミドアデニンジヌクレオチド
ニコチンアミドアデニンジヌクレオチド ウリジン二リン酸グルコース
ウリジン二リン酸グルコース ポリエチレングリコール
ポリエチレングリコール 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 回転陽極 / タイプ: RIGAKU RUH2R / 波長: 1.5418
回転陽極 / タイプ: RIGAKU RUH2R / 波長: 1.5418  : 1.5418 Å / 相対比: 1
: 1.5418 Å / 相対比: 1  解析
解析 : FOURIER DIFFERENCE / 解像度: 1.9→30 Å / σ(F): 0 / 立体化学のターゲット値: TNT PROTGEO
: FOURIER DIFFERENCE / 解像度: 1.9→30 Å / σ(F): 0 / 立体化学のターゲット値: TNT PROTGEO ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj




