+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of F-actin in the Mg2+-ADP nucleotide state. | |||||||||||||||
 マップデータ マップデータ | Sharpened, local-resolution filtered cryo-EM density map of F-actin in the Mg2 -ADP nucleotide state. | |||||||||||||||
 試料 試料 |
| |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoskeletal motor activator activity /  tropomyosin binding / tropomyosin binding /  myosin heavy chain binding / mesenchyme migration / myosin heavy chain binding / mesenchyme migration /  troponin I binding / actin filament bundle / filamentous actin / skeletal muscle thin filament assembly / actin filament bundle assembly / striated muscle thin filament ...cytoskeletal motor activator activity / troponin I binding / actin filament bundle / filamentous actin / skeletal muscle thin filament assembly / actin filament bundle assembly / striated muscle thin filament ...cytoskeletal motor activator activity /  tropomyosin binding / tropomyosin binding /  myosin heavy chain binding / mesenchyme migration / myosin heavy chain binding / mesenchyme migration /  troponin I binding / actin filament bundle / filamentous actin / skeletal muscle thin filament assembly / actin filament bundle assembly / striated muscle thin filament / skeletal muscle myofibril / actin monomer binding / skeletal muscle fiber development / troponin I binding / actin filament bundle / filamentous actin / skeletal muscle thin filament assembly / actin filament bundle assembly / striated muscle thin filament / skeletal muscle myofibril / actin monomer binding / skeletal muscle fiber development /  stress fiber / stress fiber /  titin binding / actin filament polymerization / titin binding / actin filament polymerization /  filopodium / filopodium /  マイクロフィラメント / マイクロフィラメント /  加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / calcium-dependent protein binding / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / calcium-dependent protein binding /  lamellipodium / lamellipodium /  cell body / cell body /  hydrolase activity / protein domain specific binding / hydrolase activity / protein domain specific binding /  calcium ion binding / positive regulation of gene expression / magnesium ion binding / calcium ion binding / positive regulation of gene expression / magnesium ion binding /  ATP binding / identical protein binding / ATP binding / identical protein binding /  細胞質 細胞質類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Oryctolagus cuniculus (ウサギ) / Oryctolagus cuniculus (ウサギ) /   rabbit (ウサギ) rabbit (ウサギ) | |||||||||||||||
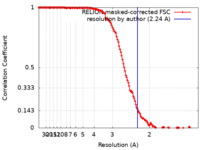
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.24 Å クライオ電子顕微鏡法 / 解像度: 2.24 Å | |||||||||||||||
 データ登録者 データ登録者 | Oosterheert W / Klink BU / Belyy A / Pospich S / Raunser S | |||||||||||||||
| 資金援助 | European Union,  ドイツ, 4件 ドイツ, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: Structural basis of actin filament assembly and aging. 著者: Wout Oosterheert / Björn U Klink / Alexander Belyy / Sabrina Pospich / Stefan Raunser /  要旨: The dynamic turnover of actin filaments (F-actin) controls cellular motility in eukaryotes and is coupled to changes in the F-actin nucleotide state. It remains unclear how F-actin hydrolyses ATP and ...The dynamic turnover of actin filaments (F-actin) controls cellular motility in eukaryotes and is coupled to changes in the F-actin nucleotide state. It remains unclear how F-actin hydrolyses ATP and subsequently undergoes subtle conformational rearrangements that ultimately lead to filament depolymerization by actin-binding proteins. Here we present cryo-electron microscopy structures of F-actin in all nucleotide states, polymerized in the presence of Mg or Ca at approximately 2.2 Å resolution. The structures show that actin polymerization induces the relocation of water molecules in the nucleotide-binding pocket, activating one of them for the nucleophilic attack of ATP. Unexpectedly, the back door for the subsequent release of inorganic phosphate (P) is closed in all structures, indicating that P release occurs transiently. The small changes in the nucleotide-binding pocket after ATP hydrolysis and P release are sensed by a key amino acid, amplified and transmitted to the filament periphery. Furthermore, differences in the positions of water molecules in the nucleotide-binding pocket explain why Ca-actin shows slower polymerization rates than Mg-actin. Our work elucidates the solvent-driven rearrangements that govern actin filament assembly and aging and lays the foundation for the rational design of drugs and small molecules for imaging and therapeutic applications. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15106.map.gz emd_15106.map.gz | 131.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15106-v30.xml emd-15106-v30.xml emd-15106.xml emd-15106.xml | 25 KB 25 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15106_fsc.xml emd_15106_fsc.xml | 13.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15106.png emd_15106.png | 88.8 KB | ||
| マスクデータ |  emd_15106_msk_1.map emd_15106_msk_1.map | 216 MB |  マスクマップ マスクマップ | |
| その他 |  emd_15106_additional_1.map.gz emd_15106_additional_1.map.gz emd_15106_half_map_1.map.gz emd_15106_half_map_1.map.gz emd_15106_half_map_2.map.gz emd_15106_half_map_2.map.gz | 168.3 MB 170 MB 169.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15106 http://ftp.pdbj.org/pub/emdb/structures/EMD-15106 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15106 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15106 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15106.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15106.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened, local-resolution filtered cryo-EM density map of F-actin in the Mg2 -ADP nucleotide state. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.695 Å | ||||||||||||||||||||||||||||||||||||
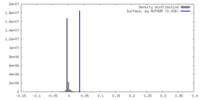
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_15106_msk_1.map emd_15106_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
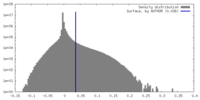
| 密度ヒストグラム |
-追加マップ: 3D-refined, unsharpened cryo-EM density map of F-actin in...
| ファイル | emd_15106_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3D-refined, unsharpened cryo-EM density map of F-actin in the Mg2 -ADP nucleotide state. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
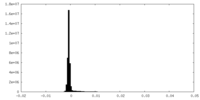
| 密度ヒストグラム |
-ハーフマップ: Unfiltered half map 1 of F-actin in the Mg2 -ADP nucleotide state.
| ファイル | emd_15106_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unfiltered half map 1 of F-actin in the Mg2 -ADP nucleotide state. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
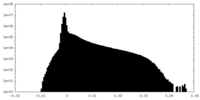
| 密度ヒストグラム |
-ハーフマップ: Unfiltered half map 2 of F-actin in the Mg2 -ADP nucleotide state.
| ファイル | emd_15106_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unfiltered half map 2 of F-actin in the Mg2 -ADP nucleotide state. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : rabbit skeletal alpha-actin in the filamentous state.
| 全体 | 名称: rabbit skeletal alpha-actin in the filamentous state. |
|---|---|
| 要素 |
|
-超分子 #1: rabbit skeletal alpha-actin in the filamentous state.
| 超分子 | 名称: rabbit skeletal alpha-actin in the filamentous state. タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: The helical rise of F-actin is 27.5 Angstrom, with a helical twist of ~166.5 degrees. |
|---|---|
| 由来(天然) | 生物種:   Oryctolagus cuniculus (ウサギ) / 器官: skeletal muscle / 組織: purified from muscle acetone powder Oryctolagus cuniculus (ウサギ) / 器官: skeletal muscle / 組織: purified from muscle acetone powder |
| 分子量 | 理論値: 15.2 kDa/nm |
-分子 #1: Actin, alpha skeletal muscle
| 分子 | 名称: Actin, alpha skeletal muscle / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   rabbit (ウサギ) / 器官: skeletal muscle rabbit (ウサギ) / 器官: skeletal muscle |
| 分子量 | 理論値: 41.875633 KDa |
| 配列 | 文字列: DEDETTALVC DNGSGLVKAG FAGDDAPRAV FPSIVGRPRH QGVMVGMGQK DSYVGDEAQS KRGILTLKYP IE(HIC)GII TNW DDMEKIWHHT FYNELRVAPE EHPTLLTEAP LNPKANREKM TQIMFETFNV PAMYVAIQAV LSLYASGRTT GIVLDSG DG ...文字列: DEDETTALVC DNGSGLVKAG FAGDDAPRAV FPSIVGRPRH QGVMVGMGQK DSYVGDEAQS KRGILTLKYP IE(HIC)GII TNW DDMEKIWHHT FYNELRVAPE EHPTLLTEAP LNPKANREKM TQIMFETFNV PAMYVAIQAV LSLYASGRTT GIVLDSG DG VTHNVPIYEG YALPHAIMRL DLAGRDLTDY LMKILTERGY SFVTTAEREI VRDIKEKLCY VALDFENEMA TAASSSSL E KSYELPDGQV ITIGNERFRC PETLFQPSFI GMESAGIHET TYNSIMKCDI DIRKDLYANN VMSGGTTMYP GIADRMQKE ITALAPSTMK IKIIAPPERK YSVWIGGSIL ASLSTFQQMW ITKQEYDEAG PSIVHRKCF |
-分子 #2: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 5 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #3: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 3 / コピー数: 5 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #4: water
| 分子 | 名称: water / タイプ: ligand / ID: 4 / コピー数: 556 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: F-buffer: 5 mM Tris pH 7.5, 100 mM KCl, 2 mM MgCl2, 2 mM NaN3, 1 mM DTT | ||||||||||||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 286 K / 装置: FEI VITROBOT MARK IV 詳細: The Vitrobot was operated at 13 degrees celsius and the samples were blotted for 9 seconds with a blot force of -25.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 130000 |
| 特殊光学系 | エネルギーフィルター - スリット幅: 15 eV |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 撮影したグリッド数: 2 / 実像数: 9842 / 平均露光時間: 3.0 sec. / 平均電子線量: 76.4 e/Å2 / 詳細: Images were collected in supperresolution mode. |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: |
|---|---|
| 詳細 | The structures were then refined through a similar protocol of iterative cycles in Coot and phenix real-space refine. All solvent molecules (ions, waters) were placed manually in Coot in the central actin subunit, and were then placed in the other subunits using NCS. Because the local resolution of each F-actin reconstruction is highest in the center and lower at the periphery of the map, we inspected all waters in each structure manually before the final phenix refinement; water molecular with poor corresponding cryo-EM density were removed. |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
| 得られたモデル |  PDB-8a2t: |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)