+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11238 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Respiratory complex I from Thermus thermophilus, NAD+ dataset, minor state NADH:ユビキノン還元酵素 (水素イオン輸送型) NADH:ユビキノン還元酵素 (水素イオン輸送型) | |||||||||
 マップデータ マップデータ | Postprocessed map, NAD dataset, minor state | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Respiratory chain (電子伝達系) / Respiratory chain (電子伝達系) /  complex I (NADH:ユビキノン還元酵素 (水素イオン輸送型)) / complex I (NADH:ユビキノン還元酵素 (水素イオン輸送型)) /  NADH:ubiquinone oxidoreductase / NADH:ubiquinone oxidoreductase /  electron transfer (電子移動反応) / proton translocation / electron transfer (電子移動反応) / proton translocation /  MEMBRANE PROTEIN (膜タンパク質) MEMBRANE PROTEIN (膜タンパク質) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / respiratory chain complex I / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor /  iron-sulfur cluster assembly / iron-sulfur cluster assembly /  NADH dehydrogenase (ubiquinone) activity / NADH dehydrogenase (ubiquinone) activity /  quinone binding / ATP synthesis coupled electron transport / quinone binding / ATP synthesis coupled electron transport /  ferric iron binding ...トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / respiratory chain complex I / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor / ferric iron binding ...トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / respiratory chain complex I / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor /  iron-sulfur cluster assembly / iron-sulfur cluster assembly /  NADH dehydrogenase (ubiquinone) activity / NADH dehydrogenase (ubiquinone) activity /  quinone binding / ATP synthesis coupled electron transport / quinone binding / ATP synthesis coupled electron transport /  ferric iron binding / 2 iron, 2 sulfur cluster binding / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding / ferric iron binding / 2 iron, 2 sulfur cluster binding / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding /  oxidoreductase activity / iron ion binding / oxidoreductase activity / iron ion binding /  metal ion binding / metal ion binding /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||
| 生物種 |    Thermus thermophilus (サーマス・サーモフィルス) Thermus thermophilus (サーマス・サーモフィルス) | |||||||||
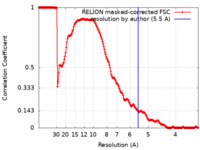
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 5.5 Å クライオ電子顕微鏡法 / 解像度: 5.5 Å | |||||||||
 データ登録者 データ登録者 | Kaszuba K / Tambalo M | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2020 ジャーナル: Nat Commun / 年: 2020タイトル: Key role of quinone in the mechanism of respiratory complex I. 著者: Javier Gutiérrez-Fernández / Karol Kaszuba / Gurdeep S Minhas / Rozbeh Baradaran / Margherita Tambalo / David T Gallagher / Leonid A Sazanov /    要旨: Complex I is the first and the largest enzyme of respiratory chains in bacteria and mitochondria. The mechanism which couples spatially separated transfer of electrons to proton translocation in ...Complex I is the first and the largest enzyme of respiratory chains in bacteria and mitochondria. The mechanism which couples spatially separated transfer of electrons to proton translocation in complex I is not known. Here we report five crystal structures of T. thermophilus enzyme in complex with NADH or quinone-like compounds. We also determined cryo-EM structures of major and minor native states of the complex, differing in the position of the peripheral arm. Crystal structures show that binding of quinone-like compounds (but not of NADH) leads to a related global conformational change, accompanied by local re-arrangements propagating from the quinone site to the nearest proton channel. Normal mode and molecular dynamics analyses indicate that these are likely to represent the first steps in the proton translocation mechanism. Our results suggest that quinone binding and chemistry play a key role in the coupling mechanism of complex I. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11238.map.gz emd_11238.map.gz | 480.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11238-v30.xml emd-11238-v30.xml emd-11238.xml emd-11238.xml | 30.3 KB 30.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_11238_fsc.xml emd_11238_fsc.xml | 17.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_11238.png emd_11238.png | 57.2 KB | ||
| Filedesc metadata |  emd-11238.cif.gz emd-11238.cif.gz | 9.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11238 http://ftp.pdbj.org/pub/emdb/structures/EMD-11238 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11238 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11238 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6zjyMC  6i0dC  6i1pC  6q8oC  6q8wC  6q8xC  6y11C  6ziyC  6zjlC  6zjnC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11238.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11238.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Postprocessed map, NAD dataset, minor state | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.72 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
+全体 : Respiratory complex I from Thermus thermophilus
+超分子 #1: Respiratory complex I from Thermus thermophilus
+分子 #1: NADH-quinone oxidoreductase subunit 1
+分子 #2: NADH-quinone oxidoreductase subunit 2
+分子 #3: NADH-quinone oxidoreductase subunit 3
+分子 #4: NADH-quinone oxidoreductase subunit 4
+分子 #5: NADH-quinone oxidoreductase subunit 5
+分子 #6: NADH-quinone oxidoreductase subunit 6
+分子 #7: NADH-quinone oxidoreductase subunit 9
+分子 #8: NADH-quinone oxidoreductase subunit 15
+分子 #9: NADH-quinone oxidoreductase subunit 7
+分子 #10: NADH-quinone oxidoreductase subunit 10
+分子 #11: NADH-quinone oxidoreductase subunit 11
+分子 #12: NADH-quinone oxidoreductase subunit 12
+分子 #13: NADH-quinone oxidoreductase subunit 13
+分子 #14: NADH-quinone oxidoreductase subunit 14
+分子 #15: NADH-quinone oxidoreductase subunit 8
+分子 #16: IRON/SULFUR CLUSTER
+分子 #17: FE2/S2 (INORGANIC) CLUSTER
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 6.0 mg/mL |
|---|---|
| 緩衝液 | pH: 6 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK III |
| 詳細 | with 5 mM NAD+ |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 2.5 µm Bright-field microscopy / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 2.5 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 検出モード: INTEGRATING / デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / デジタル化 - 画像ごとのフレーム数: 1-34 / 撮影したグリッド数: 1 / 実像数: 710 / 平均露光時間: 2.0 sec. / 平均電子線量: 34.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー