| 登録情報 | データベース: PDB / ID: 9myx
|
|---|
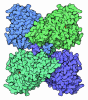
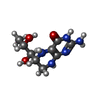
| タイトル | Structure of rat neuronal nitric oxide synthase R349A mutant heme domain bound with 7-(3-aminomethyl)phenyl-6-fluoro-4-methylquinoin-2-amine |
|---|
 要素 要素 | Nitric oxide synthase, brain |
|---|
 キーワード キーワード | OXIDOREDUCTASE / nitric oxide synthase inhibitor binding / OXIDOREDUCTASE-INHIBITOR complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of hepatic stellate cell contraction / Nitric oxide stimulates guanylate cyclase / positive regulation of adenylate cyclase-activating adrenergic receptor signaling pathway / negative regulation of iron ion transmembrane transport / response to vitamin B3 / postsynaptic specialization, intracellular component / ROS and RNS production in phagocytes / azurophil granule / Ion homeostasis / synaptic signaling by nitric oxide ...negative regulation of hepatic stellate cell contraction / Nitric oxide stimulates guanylate cyclase / positive regulation of adenylate cyclase-activating adrenergic receptor signaling pathway / negative regulation of iron ion transmembrane transport / response to vitamin B3 / postsynaptic specialization, intracellular component / ROS and RNS production in phagocytes / azurophil granule / Ion homeostasis / synaptic signaling by nitric oxide / negative regulation of vasoconstriction / response to nitric oxide / positive regulation of adenylate cyclase-activating G protein-coupled receptor signaling pathway / response to vitamin E / negative regulation of cytosolic calcium ion concentration / positive regulation of sodium ion transmembrane transport / peptidyl-cysteine S-nitrosylase activity / positive regulation of the force of heart contraction / cadmium ion binding / negative regulation of calcium ion transport / negative regulation of potassium ion transport / regulation of postsynaptic membrane potential / nitric oxide mediated signal transduction / sodium channel regulator activity / nitric-oxide synthase (NADPH) / regulation of neurogenesis / negative regulation of serotonin uptake / nitric-oxide synthase activity / multicellular organismal response to stress / xenobiotic catabolic process / postsynaptic density, intracellular component / NADPH binding / L-arginine catabolic process / striated muscle contraction / nitric oxide-cGMP-mediated signaling / negative regulation of blood pressure / regulation of sodium ion transport / behavioral response to cocaine / response to hormone / nitric oxide metabolic process / photoreceptor inner segment / nitric oxide biosynthetic process / cellular response to epinephrine stimulus / T-tubule / sarcoplasmic reticulum membrane / secretory granule / calyx of Held / sarcoplasmic reticulum / positive regulation of long-term synaptic potentiation / response to activity / cell periphery / response to nicotine / response to nutrient levels / phosphoprotein binding / establishment of protein localization / establishment of localization in cell / cellular response to mechanical stimulus / female pregnancy / negative regulation of insulin secretion / response to peptide hormone / sarcolemma / caveola / potassium ion transport / response to lead ion / cellular response to growth factor stimulus / response to estrogen / vasodilation / Z disc / calcium-dependent protein binding / calcium ion transport / FMN binding / NADP binding / flavin adenine dinucleotide binding / positive regulation of neuron apoptotic process / ATPase binding / response to heat / scaffold protein binding / response to ethanol / nuclear membrane / response to lipopolysaccharide / dendritic spine / negative regulation of neuron apoptotic process / RNA polymerase II-specific DNA-binding transcription factor binding / transmembrane transporter binding / mitochondrial outer membrane / calmodulin binding / response to hypoxia / cytoskeleton / postsynaptic density / membrane raft / negative regulation of cell population proliferation / heme binding / synapse / dendrite / negative regulation of apoptotic process / positive regulation of DNA-templated transcription / perinuclear region of cytoplasm / glutamatergic synapse / enzyme binding / positive regulation of transcription by RNA polymerase II類似検索 - 分子機能 Nitric-oxide synthase, eukaryote / Nitric oxide synthase, N-terminal / Nitric oxide synthase, N-terminal domain superfamily / Nitric oxide synthase, domain 2 superfamily / Nitric oxide synthase, domain 1 superfamily / Nitric oxide synthase, domain 3 superfamily / : / Nitric oxide synthase, oxygenase domain / Nitric oxide synthase (NOS) signature. / Sulfite reductase [NADPH] flavoprotein alpha-component-like, FAD-binding ...Nitric-oxide synthase, eukaryote / Nitric oxide synthase, N-terminal / Nitric oxide synthase, N-terminal domain superfamily / Nitric oxide synthase, domain 2 superfamily / Nitric oxide synthase, domain 1 superfamily / Nitric oxide synthase, domain 3 superfamily / : / Nitric oxide synthase, oxygenase domain / Nitric oxide synthase (NOS) signature. / Sulfite reductase [NADPH] flavoprotein alpha-component-like, FAD-binding / NADPH-cytochrome p450 reductase, FAD-binding, alpha-helical domain superfamily / FAD binding domain / Flavodoxin-like / Flavoprotein pyridine nucleotide cytochrome reductase / Flavodoxin / Flavodoxin-like domain profile. / Flavodoxin/nitric oxide synthase / Oxidoreductase FAD/NAD(P)-binding / Oxidoreductase NAD-binding domain / PDZ domain / FAD-binding domain, ferredoxin reductase-type / Ferredoxin-NADP reductase (FNR), nucleotide-binding domain / Ferredoxin reductase-type FAD binding domain profile. / Riboflavin synthase-like beta-barrel / Flavoprotein-like superfamily / PDZ domain profile. / Domain present in PSD-95, Dlg, and ZO-1/2. / PDZ domain / PDZ superfamily類似検索 - ドメイン・相同性 : / ACETATE ION / 5,6,7,8-TETRAHYDROBIOPTERIN / PROTOPORPHYRIN IX CONTAINING FE / Nitric oxide synthase 1類似検索 - 構成要素 |
|---|
| 生物種 |   Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 1.821 Å フーリエ合成 / 解像度: 1.821 Å |
|---|
 データ登録者 データ登録者 | Li, H. / Poulos, T.L. |
|---|
| 資金援助 |  米国, 1件 米国, 1件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) | GM131920 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Published
タイトル: Design and synthesis of 7-aryl-6-fluoro-2-aminoquinolines as potent and highly selective human neuronal nitric oxide synthase inhibitors
著者: Ansari, A. / Rathnayake, A.D. / Li, H. / Hardy, C.D. / Poulos, T.L. / Silverman, R.B. |
|---|
| 履歴 | | 登録 | 2025年1月22日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2025年12月3日 | Provider: repository / タイプ: Initial release |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  フーリエ合成 / 解像度: 1.821 Å
フーリエ合成 / 解像度: 1.821 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: To Be Published
ジャーナル: To Be Published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 9myx.cif.gz
9myx.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb9myx.ent.gz
pdb9myx.ent.gz PDB形式
PDB形式 9myx.json.gz
9myx.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 9myx_validation.pdf.gz
9myx_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 9myx_full_validation.pdf.gz
9myx_full_validation.pdf.gz 9myx_validation.xml.gz
9myx_validation.xml.gz 9myx_validation.cif.gz
9myx_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/my/9myx
https://data.pdbj.org/pub/pdb/validation_reports/my/9myx ftp://data.pdbj.org/pub/pdb/validation_reports/my/9myx
ftp://data.pdbj.org/pub/pdb/validation_reports/my/9myx










 F&H 検索
F&H 検索 リンク
リンク 集合体
集合体

 要素
要素









 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ALS
ALS  / ビームライン: 5.0.2 / 波長: 0.97946 Å
/ ビームライン: 5.0.2 / 波長: 0.97946 Å 解析
解析 フーリエ合成 / 解像度: 1.821→39.687 Å / SU ML: 0.26 / 交差検証法: FREE R-VALUE / σ(F): 0.02 / 位相誤差: 45.56 / 立体化学のターゲット値: ML
フーリエ合成 / 解像度: 1.821→39.687 Å / SU ML: 0.26 / 交差検証法: FREE R-VALUE / σ(F): 0.02 / 位相誤差: 45.56 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj