+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9e3c | ||||||
|---|---|---|---|---|---|---|---|
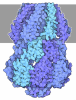
| タイトル | Cryo-EM structure of PRMT5/WDR77 in complex with 6S complex (GRG local refine) | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSFERASE / PRMT5 / Methyl transferase / WDR77 / arginine | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of adenylate cyclase-inhibiting dopamine receptor signaling pathway / peptidyl-arginine N-methylation / type II protein arginine methyltransferase / protein-arginine omega-N symmetric methyltransferase activity / peptidyl-arginine methylation / Golgi ribbon formation / histone H4R3 methyltransferase activity / : / U12-type spliceosomal complex / 7-methylguanosine cap hypermethylation ...positive regulation of adenylate cyclase-inhibiting dopamine receptor signaling pathway / peptidyl-arginine N-methylation / type II protein arginine methyltransferase / protein-arginine omega-N symmetric methyltransferase activity / peptidyl-arginine methylation / Golgi ribbon formation / histone H4R3 methyltransferase activity / : / U12-type spliceosomal complex / 7-methylguanosine cap hypermethylation / U1 snRNP binding / protein-arginine N-methyltransferase activity / methylosome / pICln-Sm protein complex / positive regulation of mRNA splicing, via spliceosome / SMN-Sm protein complex / small nuclear ribonucleoprotein complex / spliceosomal tri-snRNP complex / methyl-CpG binding / U2-type precatalytic spliceosome / commitment complex / U2-type spliceosomal complex / U2-type prespliceosome assembly / U2-type catalytic step 2 spliceosome / endothelial cell activation / U2 snRNP / U1 snRNP / U4 snRNP / histone H3 methyltransferase activity / histone methyltransferase activity / regulation of mitotic nuclear division / precatalytic spliceosome / negative regulation of gene expression via chromosomal CpG island methylation / spliceosomal complex assembly / mRNA Splicing - Minor Pathway / E-box binding / histone methyltransferase complex / positive regulation of oligodendrocyte differentiation / negative regulation of cell differentiation / U5 snRNP / spliceosomal snRNP assembly / ribonucleoprotein complex binding / regulation of ERK1 and ERK2 cascade / U4/U6 x U5 tri-snRNP complex / catalytic step 2 spliceosome / liver regeneration / mRNA Splicing - Major Pathway / RNA splicing / regulation of signal transduction by p53 class mediator / methyltransferase activity / spliceosomal complex / circadian regulation of gene expression / DNA-templated transcription termination / mRNA splicing, via spliceosome / Regulation of TP53 Activity through Methylation / RMTs methylate histone arginines / p53 binding / transcription corepressor activity / snRNP Assembly / SARS-CoV-2 modulates host translation machinery / chromatin remodeling / protein heterodimerization activity / regulation of DNA-templated transcription / chromatin / Golgi apparatus / RNA binding / nucleoplasm / identical protein binding / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.19 Å | ||||||
 データ登録者 データ登録者 | Jin, C.Y. / Hunkeler, M. / Fischer, E.S. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2025 ジャーナル: J Biol Chem / 年: 2025タイトル: Substrate adaptors are flexible tethering modules that enhance substrate methylation by the arginine methyltransferase PRMT5. 著者: Cyrus Y Jin / Moritz Hunkeler / Kathleen M Mulvaney / William R Sellers / Eric S Fischer /  要旨: Protein arginine methyltransferase (PRMT) 5 is an essential arginine methyltransferase responsible for the majority of cellular symmetric dimethyl-arginine marks. PRMT5 uses substrate adaptors such ...Protein arginine methyltransferase (PRMT) 5 is an essential arginine methyltransferase responsible for the majority of cellular symmetric dimethyl-arginine marks. PRMT5 uses substrate adaptors such as pICln, RIOK1, and COPR5 to recruit and methylate a wide range of substrates. Although the substrate adaptors play important roles in substrate recognition, how they direct PRMT5 activity towards specific substrates remains incompletely understood. Using biochemistry and cryogenic electron microscopy, we show that these adaptors compete for the same binding site on PRMT5. We find that substrate adaptor and substrate complexes are bound to PRMT5 through two peptide motifs, enabling these adaptors to act as flexible tethering modules to enhance substrate methylation. Taken together, our results shed structural and mechanistic light on the PRMT5 substrate adaptor function and the biochemical nature of PRMT5 interactors. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9e3c.cif.gz 9e3c.cif.gz | 310.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9e3c.ent.gz pdb9e3c.ent.gz | 201.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  9e3c.json.gz 9e3c.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9e3c_validation.pdf.gz 9e3c_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9e3c_full_validation.pdf.gz 9e3c_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  9e3c_validation.xml.gz 9e3c_validation.xml.gz | 38.2 KB | 表示 | |
| CIF形式データ |  9e3c_validation.cif.gz 9e3c_validation.cif.gz | 54.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/e3/9e3c https://data.pdbj.org/pub/pdb/validation_reports/e3/9e3c ftp://data.pdbj.org/pub/pdb/validation_reports/e3/9e3c ftp://data.pdbj.org/pub/pdb/validation_reports/e3/9e3c | HTTPS FTP |
-関連構造データ
| 関連構造データ |  47478MC  9e3aC  9e3bC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 72766.664 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PRMT5, HRMT1L5, IBP72, JBP1, SKB1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PRMT5, HRMT1L5, IBP72, JBP1, SKB1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ)参照: UniProt: O14744, type II protein arginine methyltransferase |
|---|---|
| #2: タンパク質 | 分子量: 13954.288 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: SNRPD1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: SNRPD1 / 発現宿主:  |
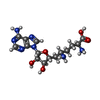
| #3: 化合物 | ChemComp-SFG / |
| 研究の焦点であるリガンドがあるか | Y |
| Has protein modification | N |
| 配列の詳細 | The precise residue numbers of the amino acid residues in chain M (snRNP Sm D1) cannot be ...The precise residue numbers of the amino acid residues in chain M (snRNP Sm D1) cannot be determined because of the number of GR repeats near the C-terminus of the protein. They are numbered as residues 109-114. However, this region could actually be 97-102, or any stretch of GRGRGR between residues 97 and 114. |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.77 MDa / 実験値: NO | ||||||||||||||||||||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.4 詳細: 30 mM HEPES pH 7.4, 150 mM NaCl, 3 mM TCEP, 3.33 mM sinefungin | ||||||||||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 1 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||||||||||||||||||||||||
| 急速凍結 | 装置: LEICA EM GP / 凍結剤: ETHANE / 湿度: 90 % / 凍結前の試料温度: 283 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: TFS TALOS |
|---|---|
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 36000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 800 nm / Cs: 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 5 sec. / 電子線照射量: 53.112 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 3615 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 画像処理 | 詳細: motioncorrected on the fly by cryosparc live | ||||||||||||||||||||||||||||||||||||||||
| CTF補正 | 詳細: as implemented in cryosparc live / タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2100293 / 詳細: topaz | ||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.19 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 530317 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 110.3 / プロトコル: OTHER / 空間: REAL / Target criteria: real space correlation | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 6V0O PDB chain-ID: A / Accession code: 6V0O / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 121.42 Å2 | ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





 PDBj
PDBj