+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9d3c | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Gly-,Glu-,(S)-(+)-ketamine bound GluN1a-2B-2D NMDAR | |||||||||||||||||||||||||||
 要素 要素 | (Glutamate receptor ionotropic, NMDA ...) x 3 | |||||||||||||||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / N-methyl-D-aspartate receptor / (S)-(+)-ketamine / GluN2B / GluN2D | |||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of sensory perception of pain / glycine-gated cation channel activity / excitatory chemical synaptic transmission / Activated NTRK2 signals through FYN / Synaptic adhesion-like molecules / response to glycine / propylene metabolic process / cellular response to L-glutamate / negative regulation of dendritic spine maintenance / Assembly and cell surface presentation of NMDA receptors ...regulation of sensory perception of pain / glycine-gated cation channel activity / excitatory chemical synaptic transmission / Activated NTRK2 signals through FYN / Synaptic adhesion-like molecules / response to glycine / propylene metabolic process / cellular response to L-glutamate / negative regulation of dendritic spine maintenance / Assembly and cell surface presentation of NMDA receptors / regulation of monoatomic cation transmembrane transport / NMDA glutamate receptor activity / voltage-gated monoatomic cation channel activity / NMDA selective glutamate receptor complex / Neurexins and neuroligins / glutamate binding / ligand-gated sodium channel activity / neurotransmitter receptor complex / glutamate receptor signaling pathway / calcium ion transmembrane import into cytosol / protein heterotetramerization / glycine binding / startle response / monoatomic cation transmembrane transport / positive regulation of reactive oxygen species biosynthetic process / Negative regulation of NMDA receptor-mediated neuronal transmission / Unblocking of NMDA receptors, glutamate binding and activation / positive regulation of calcium ion transport into cytosol / Long-term potentiation / excitatory synapse / monoatomic cation transport / regulation of neuronal synaptic plasticity / monoatomic ion channel complex / positive regulation of excitatory postsynaptic potential / synaptic cleft / positive regulation of synaptic transmission, glutamatergic / calcium ion homeostasis / glutamate-gated receptor activity / MECP2 regulates neuronal receptors and channels / glutamate-gated calcium ion channel activity / presynaptic active zone membrane / EPHB-mediated forward signaling / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / ionotropic glutamate receptor signaling pathway / sodium ion transmembrane transport / Ras activation upon Ca2+ influx through NMDA receptor / synaptic membrane / hippocampal mossy fiber to CA3 synapse / adult locomotory behavior / regulation of membrane potential / excitatory postsynaptic potential / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / synaptic transmission, glutamatergic / postsynaptic density membrane / brain development / regulation of synaptic plasticity / visual learning / calcium ion transmembrane transport / long-term synaptic potentiation / terminal bouton / synaptic vesicle / late endosome / signaling receptor activity / amyloid-beta binding / RAF/MAP kinase cascade / response to ethanol / chemical synaptic transmission / dendritic spine / postsynaptic membrane / learning or memory / cytoskeleton / calmodulin binding / lysosome / neuron projection / postsynaptic density / calcium ion binding / synapse / dendrite / endoplasmic reticulum membrane / protein-containing complex binding / glutamatergic synapse / cell surface / positive regulation of transcription by RNA polymerase II / zinc ion binding / plasma membrane / cytoplasm 類似検索 - 分子機能 | |||||||||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.96 Å | |||||||||||||||||||||||||||
 データ登録者 データ登録者 | Hyunook, K. / Hiro, F. | |||||||||||||||||||||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Neuron / 年: 2025 ジャーナル: Neuron / 年: 2025タイトル: Structural basis for channel gating and blockade in tri-heteromeric GluN1-2B-2D NMDA receptor. 著者: Hyunook Kang / Max Epstein / Tue G Banke / Riley Perszyk / Noriko Simorowski / Srinu Paladugu / Dennis C Liotta / Stephen F Traynelis / Hiro Furukawa /  要旨: Discrete activation of N-methyl-D-aspartate receptor (NMDAR) subtypes by glutamate and the co-agonist glycine is fundamental to neuroplasticity. A distinct variant, the tri-heteromeric receptor, ...Discrete activation of N-methyl-D-aspartate receptor (NMDAR) subtypes by glutamate and the co-agonist glycine is fundamental to neuroplasticity. A distinct variant, the tri-heteromeric receptor, comprising glycine-binding GluN1 and two types of glutamate-binding GluN2 subunits, exhibits unique pharmacological characteristics, notably enhanced sensitivity to the anti-depressant channel blocker S-(+)-ketamine. Despite its significance, the structural mechanisms underlying ligand gating and channel blockade of tri-heteromeric NMDARs remain poorly understood. Here, we identify and characterize tri-heteromeric GluN1-2B-2D NMDAR in the adult brain, resolving its structures in the activated, inhibited, and S-(+)-ketamine-blocked states. These structures reveal the ligand-dependent conformational dynamics that modulate the tension between the extracellular domain and transmembrane channels, governing channel gating and blockade. Additionally, we demonstrate that the inhibitor (S)-DQP-997-74 selectively decouples linker tension in GluN2D, offering insights into subtype-selective targeting for cognitive modulation. | |||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9d3c.cif.gz 9d3c.cif.gz | 559.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9d3c.ent.gz pdb9d3c.ent.gz | 442.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  9d3c.json.gz 9d3c.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9d3c_validation.pdf.gz 9d3c_validation.pdf.gz | 698.7 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9d3c_full_validation.pdf.gz 9d3c_full_validation.pdf.gz | 740.1 KB | 表示 | |
| XML形式データ |  9d3c_validation.xml.gz 9d3c_validation.xml.gz | 63.7 KB | 表示 | |
| CIF形式データ |  9d3c_validation.cif.gz 9d3c_validation.cif.gz | 95.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d3/9d3c https://data.pdbj.org/pub/pdb/validation_reports/d3/9d3c ftp://data.pdbj.org/pub/pdb/validation_reports/d3/9d3c ftp://data.pdbj.org/pub/pdb/validation_reports/d3/9d3c | HTTPS FTP |
-関連構造データ
| 関連構造データ |  46531MC  9d37C  9d38C  9d39C  9d3aC  9d3bC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Glutamate receptor ionotropic, NMDA ... , 3種, 4分子 ACBD
| #1: タンパク質 | 分子量: 92691.828 Da / 分子数: 2 / 変異: R844N, R845G, K846A / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GRIN1, NMDAR1 Homo sapiens (ヒト) / 遺伝子: GRIN1, NMDAR1発現宿主:  参照: UniProt: Q05586 #2: タンパク質 | | 分子量: 98622.172 Da / 分子数: 1 / 変異: S588C, C838S, C849S / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GRIN2B, NMDAR2B Homo sapiens (ヒト) / 遺伝子: GRIN2B, NMDAR2B発現宿主:  参照: UniProt: Q13224 #3: タンパク質 | | 分子量: 94120.609 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GRIN2D, GluN2D, NMDAR2D Homo sapiens (ヒト) / 遺伝子: GRIN2D, GluN2D, NMDAR2D発現宿主:  参照: UniProt: O15399 |
|---|
-糖 , 2種, 9分子 
| #4: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
|---|---|
| #6: 糖 | ChemComp-NAG / |
-非ポリマー , 3種, 5分子 

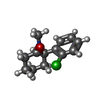


| #5: 化合物 | | #7: 化合物 | #8: 化合物 | ChemComp-JC9 / ( | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: tri-heteromeric GluN1-2B-2D NMDAR / タイプ: COMPLEX / Entity ID: #1-#3 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 0.377 MDa / 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.5 |
| 試料 | 濃度: 1 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 278 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 800 nm |
| 試料ホルダ | 凍結剤: NITROGEN |
| 撮影 | 電子線照射量: 77.7 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum / エネルギーフィルタースリット幅: 14 eV |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 633052 | ||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.96 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 77112 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL | ||||||||||||||||||||||||||||||
| 原子モデル構築 | 3D fitting-ID: 1 / Source name: PDB / タイプ: experimental model
| ||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj



















