+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9bdt | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
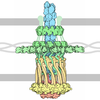
| タイトル | Apolipoprotein B 100 bound to LDL receptor and legobody | ||||||||||||||||||||||||
 要素 要素 |
| ||||||||||||||||||||||||
 キーワード キーワード | LIPID TRANSPORT / LDL / ApoB100 / LDL receptor | ||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報mature chylomicron / Scavenging by Class H Receptors / triglyceride mobilization / positive regulation of cholesterol storage / VLDL assembly / regulation of cholesterol biosynthetic process / receptor-mediated endocytosis involved in cholesterol transport / regulation of phosphatidylcholine catabolic process / plasma lipoprotein particle clearance / LDL remodeling ...mature chylomicron / Scavenging by Class H Receptors / triglyceride mobilization / positive regulation of cholesterol storage / VLDL assembly / regulation of cholesterol biosynthetic process / receptor-mediated endocytosis involved in cholesterol transport / regulation of phosphatidylcholine catabolic process / plasma lipoprotein particle clearance / LDL remodeling / Scavenging by Class B Receptors / positive regulation of lysosomal protein catabolic process / lipase binding / negative regulation of astrocyte activation / VLDL clearance / negative regulation of microglial cell activation / triglyceride catabolic process / very-low-density lipoprotein particle assembly / very-low-density lipoprotein particle receptor activity / PCSK9-LDLR complex / cholesterol import / low-density lipoprotein particle clearance / positive regulation of triglyceride biosynthetic process / negative regulation of receptor recycling / clathrin heavy chain binding / intestinal cholesterol absorption / chylomicron remnant / intermediate-density lipoprotein particle / low-density lipoprotein particle receptor activity / Chylomicron clearance / amyloid-beta clearance by cellular catabolic process / Chylomicron remodeling / low-density lipoprotein particle binding / cellular response to lipoprotein particle stimulus / regulation of protein metabolic process / Chylomicron assembly / LDL clearance / response to caloric restriction / high-density lipoprotein particle clearance / Regulation of TLR by endogenous ligand / positive regulation of lipid storage / chylomicron / phospholipid transport / lipoprotein catabolic process / flagellated sperm motility / low-density lipoprotein particle / lipoprotein biosynthetic process / cholesterol transfer activity / cholesterol transport / very-low-density lipoprotein particle / low-density lipoprotein particle remodeling / cellular response to fatty acid / negative regulation of amyloid fibril formation / positive regulation of macrophage derived foam cell differentiation / fertilization / endolysosome membrane / negative regulation of low-density lipoprotein particle clearance / IgG binding / cholesterol efflux / regulation of cholesterol metabolic process / artery morphogenesis / negative regulation of protein metabolic process / Scavenging by Class A Receptors / lipoprotein transport / low-density lipoprotein particle receptor binding / Scavenging by Class F Receptors / Platelet sensitization by LDL / sorting endosome / endoplasmic reticulum exit site / lipoprotein particle binding / amyloid-beta clearance / smooth endoplasmic reticulum / cellular response to low-density lipoprotein particle stimulus / carbohydrate transmembrane transporter activity / maltose binding / maltose transport / maltodextrin transmembrane transport / long-term memory / phagocytosis / retinoid metabolic process / cholesterol metabolic process / Retinoid metabolism and transport / ATP-binding cassette (ABC) transporter complex, substrate-binding subunit-containing / clathrin-coated pit / somatodendritic compartment / lipid droplet / endocytic vesicle lumen / lysosomal lumen / receptor-mediated endocytosis / cholesterol homeostasis / endosome lumen / Cell surface interactions at the vascular wall / post-embryonic development / Post-translational protein phosphorylation / establishment of localization in cell / clathrin-coated endocytic vesicle membrane / Heme signaling / phospholipid binding / lipid metabolic process / response to virus 類似検索 - 分子機能 | ||||||||||||||||||||||||
| 生物種 |     Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.4 Å | ||||||||||||||||||||||||
 データ登録者 データ登録者 | Dearborn, A.D. / Reimund, M. / Graziano, G. / Lei, H. / Kumar, A. / Neufeld, E.B. / Remaley, A.T. / Marcotrigiano, J. | ||||||||||||||||||||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2025 ジャーナル: Nature / 年: 2025タイトル: Structure of apolipoprotein B100 bound to the low-density lipoprotein receptor. 著者: Mart Reimund / Altaira D Dearborn / Giorgio Graziano / Haotian Lei / Anthony M Ciancone / Ashish Kumar / Ronald Holewinski / Edward B Neufeld / Francis J O'Reilly / Alan T Remaley / Joseph Marcotrigiano /  要旨: Apolipoprotein B100 (apoB100) is a structural component of low-density lipoprotein (LDL) and a ligand for the LDL receptor (LDLR). Mutations in apoB100 or in LDLR cause familial ...Apolipoprotein B100 (apoB100) is a structural component of low-density lipoprotein (LDL) and a ligand for the LDL receptor (LDLR). Mutations in apoB100 or in LDLR cause familial hypercholesterolaemia, an autosomal dominant disease that is characterized by a marked increase in LDL cholesterol (LDL-C) and a higher risk of cardiovascular disease. The structure of apoB100 on LDL and its interaction with LDLR are poorly understood. Here we present the cryo-electron microscopy structures of apoB100 on LDL bound to the LDLR and a nanobody complex, which can form a C-symmetric, higher-order complex. Using local refinement, we determined high-resolution structures of the interfaces between apoB100 and LDLR. One binding interface is formed between several small-ligand-binding modules of LDLR and a series of basic patches that are scattered along a β-belt formed by apoB100, encircling LDL. The other binding interface is formed between the β-propeller domain of LDLR and the N-terminal domain of apoB100. Our results reveal how both interfaces are involved in LDL dimer formation, and how LDLR cycles between LDL- and self-bound conformations. In addition, known mutations in either apoB100 or LDLR, associated with high levels of LDL-C, are located at the LDL-LDLR interface. | ||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9bdt.cif.gz 9bdt.cif.gz | 922.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9bdt.ent.gz pdb9bdt.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  9bdt.json.gz 9bdt.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9bdt_validation.pdf.gz 9bdt_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9bdt_full_validation.pdf.gz 9bdt_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  9bdt_validation.xml.gz 9bdt_validation.xml.gz | 165.3 KB | 表示 | |
| CIF形式データ |  9bdt_validation.cif.gz 9bdt_validation.cif.gz | 245.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/bd/9bdt https://data.pdbj.org/pub/pdb/validation_reports/bd/9bdt ftp://data.pdbj.org/pub/pdb/validation_reports/bd/9bdt ftp://data.pdbj.org/pub/pdb/validation_reports/bd/9bdt | HTTPS FTP |
-関連構造データ
| 関連構造データ |  44469MC  9bd1C  9bd8C  9bdeC  9cooC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 2種, 3分子 AIR
| #1: タンパク質 | 分子量: 516167.469 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P04114 Homo sapiens (ヒト) / 参照: UniProt: P04114 |
|---|---|
| #5: タンパク質 | 分子量: 95477.023 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: LDLR / 発現宿主: Homo sapiens (ヒト) / 遺伝子: LDLR / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P01130 Homo sapiens (ヒト) / 参照: UniProt: P01130 |
-抗体 , 4種, 4分子 HLBN
| #2: 抗体 | 分子量: 25252.217 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   |
|---|---|
| #3: 抗体 | 分子量: 24095.852 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| #4: 抗体 | 分子量: 59233.246 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)   遺伝子: malE, malE_1, A9X72_23600, ACN81_05700, ACU57_23670, AM464_13530, B6R31_000964, BANRA_05111, BCB93_001091, BF481_003801, BG944_002391, BGM66_004246, BJI68_06200, BJJ90_24825, BK292_00970, ...遺伝子: malE, malE_1, A9X72_23600, ACN81_05700, ACU57_23670, AM464_13530, B6R31_000964, BANRA_05111, BCB93_001091, BF481_003801, BG944_002391, BGM66_004246, BJI68_06200, BJJ90_24825, BK292_00970, BTB68_002078, BTQ06_17300, BvCmsKKP061_03224, BvCmsSIP010_04050, C0P57_003867, C1Q91_002164, C2R31_001890, C3F40_15210, C9E67_28370, CA593_05740, CF22_001770, CG692_11710, CG704_16590, CG831_003746, CIG67_12040, CQ986_003892, CR538_23895, CR539_01985, CTR35_003815, CV83915_02005, D4M65_12865, DIV22_28370, DNX30_07695, DS732_01860, DTL43_19585, E4K51_08355, E5H86_20640, E6D34_15030, EAI46_20350, EC95NR1_03574, ECs5017, EIZ93_13775, EN85_000970, EPS97_17355, ExPECSC038_04540, F9407_08085, F9461_21760, FIJ20_18085, FJQ40_13885, FOI11_015465, FOI11_20215, FPS11_04610, FV293_00135, FWK02_22115, G3V95_18070, G4A38_02205, G4A47_04495, G9448_13225, GAI89_05080, GAJ12_13200, GJ11_25475, GKF66_19285, GNW61_17855, GOP25_18965, GP965_07770, GP975_07695, GP979_10140, GQA06_09595, GQM04_22095, GQM21_08325, GRW05_14255, GRW24_12940, GRW56_08975, GRW57_10345, GUC01_08260, H0O72_20100, HEP30_015080, HHH44_003952, HLX92_13085, HMV95_14740, HV109_22180, HV209_20940, HVW43_14700, HVY77_23840, HX086_10250, HX136_23390, I6H00_16895, I6H02_15990, J0541_001933, J5U05_001620, JNP96_01525, KV259_002584, KV317_002918, KV371_002846, KV406_003109, KV449_002737, KV455_002759, KV463_002918, KV469_002607, KV499_002898, KV500_002927, NCTC10418_07064, NCTC10429_00012, NCTC10865_05806, NCTC11126_02082, NCTC11181_01902, NCTC12950_05149, NCTC13148_04480, NCTC4450_01671, NCTC8009_08341, NCTC8179_05034, NCTC8333_05503, NCTC8500_05253, NCTC8622_01707, NCTC8960_02276, NCTC8985_03950, NCTC9706_01951, NCTC9962_03706, NEP60_16880, O5851_07355, RG28_25590, SAMEA3752557_02201, TUM18780_41180, WR15_07725, spa, SA0107, spg 発現宿主:  |
| #6: 抗体 | 分子量: 14322.896 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  発現宿主:  |
-糖 , 2種, 5分子 
| #7: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
|---|---|
| #8: 糖 | ChemComp-NAG / |
-非ポリマー , 1種, 7分子 
| #9: 化合物 | ChemComp-CA / |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Apoliprotein B 100 from LDL bound to LDL receptor and Legobody タイプ: COMPLEX / Entity ID: #2-#6 / 由来: NATURAL |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 7.4 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: C-flat-1.2/1.3 |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 600 nm |
| 撮影 | 電子線照射量: 51.38 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOCONTINUUM (6k x 4k) |
- 解析
解析
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 粒子像の選択 | 選択した粒子像数: 3689076 / 詳細: Selected with Topaz | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 5.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 527598 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj