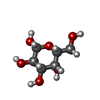
登録情報 データベース : PDB / ID : 8vcsタイトル Crystal structure of the oligomeric rMcL-1 in complex with lactose Galactose-binding lectin キーワード / / / 機能・相同性 / / / 生物種 Mytilus californianus (無脊椎動物)手法 / / 解像度 : 1.89 Å データ登録者 Hernandez-Santoyo, A. / Loera-Rubalcava, J. 資金援助 組織 認可番号 国 Not funded
ジャーナル : Int.J.Biol.Macromol. / 年 : 2025タイトル : A mytilectin from Mytilus californianus: Study of its unique galactoside interactions, oligomerization patterns, and antifungal activity.著者 : Loera-Rubalcava, J. / Garcia-Maldonado, E. / Rodriguez-Romero, A. / Quintero-Martinez, A. / Macias-Rubalcava, M.L. / Cano-Sanchez, P. / Ramirez-Rodriguez, M.A. / Espinosa-Perez, G. / Hernandez-Santoyo, A. 履歴 登録 2023年12月14日 登録サイト / 処理サイト 改定 1.0 2024年12月18日 Provider / タイプ 改定 1.1 2025年5月7日 Group / カテゴリ / citation_authorItem _citation.country / _citation.journal_abbrev ... _citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year 改定 1.2 2025年5月21日 Group / カテゴリ / Item
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Mytilus californianus (無脊椎動物)
Mytilus californianus (無脊椎動物) X線回折 /
X線回折 /  分子置換 / 解像度: 1.89 Å
分子置換 / 解像度: 1.89 Å  データ登録者
データ登録者 メキシコ, 1件
メキシコ, 1件  引用
引用 ジャーナル: Int.J.Biol.Macromol. / 年: 2025
ジャーナル: Int.J.Biol.Macromol. / 年: 2025 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 8vcs.cif.gz
8vcs.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb8vcs.ent.gz
pdb8vcs.ent.gz PDB形式
PDB形式 8vcs.json.gz
8vcs.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 8vcs_validation.pdf.gz
8vcs_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 8vcs_full_validation.pdf.gz
8vcs_full_validation.pdf.gz 8vcs_validation.xml.gz
8vcs_validation.xml.gz 8vcs_validation.cif.gz
8vcs_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/vc/8vcs
https://data.pdbj.org/pub/pdb/validation_reports/vc/8vcs ftp://data.pdbj.org/pub/pdb/validation_reports/vc/8vcs
ftp://data.pdbj.org/pub/pdb/validation_reports/vc/8vcs リンク
リンク 集合体
集合体
 要素
要素 Mytilus californianus (無脊椎動物)
Mytilus californianus (無脊椎動物)
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.54 Å
回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.54 Å 解析
解析 分子置換 / 解像度: 1.89→49.39 Å / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 19.0758
分子置換 / 解像度: 1.89→49.39 Å / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 19.0758  ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj