+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8ohs | ||||||
|---|---|---|---|---|---|---|---|
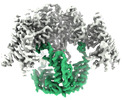
| タイトル | Core-binding domain of fungal E3-binding domain bound to the native pyruvate dehydrogenase E2 core | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSFERASE / Complex / metabolism / mitochondria | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報dihydrolipoyllysine-residue acetyltransferase / dihydrolipoyllysine-residue acetyltransferase activity / acetyl-CoA biosynthetic process from pyruvate / : 類似検索 - 分子機能 | ||||||
| 生物種 |  Neurospora crassa (菌類) Neurospora crassa (菌類) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.1 Å | ||||||
 データ登録者 データ登録者 | Forsberg, B.O. | ||||||
| 資金援助 |  スウェーデン, 1件 スウェーデン, 1件
| ||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2023 ジャーナル: Commun Biol / 年: 2023タイトル: The structure and evolutionary diversity of the fungal E3-binding protein. 著者: Bjoern O Forsberg /   要旨: The pyruvate dehydrogenase complex (PDC) is a central metabolic enzyme in all living cells composed majorly of E1, E2, and E3. Tight coupling of their reactions makes each component essential, so ...The pyruvate dehydrogenase complex (PDC) is a central metabolic enzyme in all living cells composed majorly of E1, E2, and E3. Tight coupling of their reactions makes each component essential, so that any loss impacts oxidative metabolism pathologically. E3 retention is mediated by the E3-binding protein (E3BP), which is here resolved within the PDC core from N.crassa, resolved to 3.2Å. Fungal and mammalian E3BP are shown to be orthologs, arguing E3BP as a broadly eukaryotic gene. Fungal E3BP architectures predicted from sequence data and computational models further bridge the evolutionary distance between N.crassa and humans, and suggest discriminants for E3-specificity. This is confirmed by similarities in their respective E3-binding domains, where an interaction previously not described is also predicted. This provides evolutionary parallels for a crucial interaction human metabolism, an interaction specific to fungi that can be targeted, and an example of protein evolution following gene neofunctionalization. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8ohs.cif.gz 8ohs.cif.gz | 330.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8ohs.ent.gz pdb8ohs.ent.gz | 251.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8ohs.json.gz 8ohs.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8ohs_validation.pdf.gz 8ohs_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8ohs_full_validation.pdf.gz 8ohs_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  8ohs_validation.xml.gz 8ohs_validation.xml.gz | 52.4 KB | 表示 | |
| CIF形式データ |  8ohs_validation.cif.gz 8ohs_validation.cif.gz | 79.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/oh/8ohs https://data.pdbj.org/pub/pdb/validation_reports/oh/8ohs ftp://data.pdbj.org/pub/pdb/validation_reports/oh/8ohs ftp://data.pdbj.org/pub/pdb/validation_reports/oh/8ohs | HTTPS FTP |
-関連構造データ
| 関連構造データ |  16884MC  7r5mC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 実験データセット #1 | データ参照:  10.6019/EMPIAR-10489 / データの種類: EMPIAR 10.6019/EMPIAR-10489 / データの種類: EMPIAR |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 48677.395 Da / 分子数: 6 / 由来タイプ: 天然 / 由来: (天然)  Neurospora crassa (菌類) Neurospora crassa (菌類)参照: UniProt: P20285, dihydrolipoyllysine-residue acetyltransferase #2: タンパク質 | 分子量: 44880.066 Da / 分子数: 3 / 由来タイプ: 天然 / 由来: (天然)  Neurospora crassa (菌類) / 参照: UniProt: Q7RWS2 Neurospora crassa (菌類) / 参照: UniProt: Q7RWS2 |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Native pyruvate dehydrogenase complex / タイプ: COMPLEX / Entity ID: all / 由来: NATURAL |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  Neurospora crassa (菌類) Neurospora crassa (菌類) |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TALOS ARCTICA |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 4000 nm / 最小 デフォーカス(公称値): 1000 nm |
| 撮影 | 電子線照射量: 35 e/Å2 フィルム・検出器のモデル: FEI FALCON II (4k x 4k) |
- 解析
解析
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 3次元再構成 | 解像度: 4.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 604402 / 対称性のタイプ: POINT | |||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL | |||||||||
| 原子モデル構築 | 3D fitting-ID: 1 / Accession code: 7r5m / Initial refinement model-ID: 1 / Source name: PDB / タイプ: experimental model
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj

