+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8hk1 | ||||||
|---|---|---|---|---|---|---|---|
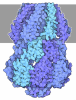
| タイトル | The cryo-EM structure of human pre-17S U2 snRNP | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | SPLICING / DDX42 / U2 snRNP / spliceosome | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報U11/U12 snRNP / U2 snRNP binding / U7 snRNA binding / histone pre-mRNA DCP binding / U7 snRNP / histone pre-mRNA 3'end processing complex / SLBP independent Processing of Histone Pre-mRNAs / SLBP Dependent Processing of Replication-Dependent Histone Pre-mRNAs / B-WICH complex / protein methylation ...U11/U12 snRNP / U2 snRNP binding / U7 snRNA binding / histone pre-mRNA DCP binding / U7 snRNP / histone pre-mRNA 3'end processing complex / SLBP independent Processing of Histone Pre-mRNAs / SLBP Dependent Processing of Replication-Dependent Histone Pre-mRNAs / B-WICH complex / protein methylation / U12-type spliceosomal complex / poly-ADP-D-ribose modification-dependent protein binding / 7-methylguanosine cap hypermethylation / U1 snRNP binding / methylosome / RNA splicing, via transesterification reactions / pICln-Sm protein complex / snRNP binding / chromatin-protein adaptor activity / protein localization to site of double-strand break / splicing factor binding / SMN-Sm protein complex / small nuclear ribonucleoprotein complex / spliceosomal tri-snRNP complex / P granule / telomerase holoenzyme complex / U2-type precatalytic spliceosome / commitment complex / mRNA cis splicing, via spliceosome / telomerase RNA binding / U2-type spliceosomal complex / U2-type prespliceosome assembly / U2-type catalytic step 2 spliceosome / SAGA complex / RNA Polymerase II Transcription Termination / U2 snRNP / U1 snRNP / U4 snRNP / U2-type prespliceosome / positive regulation of transcription by RNA polymerase III / precatalytic spliceosome / regulation of RNA splicing / spliceosomal complex assembly / mRNA Splicing - Minor Pathway / mRNA 3'-splice site recognition / positive regulation of transcription by RNA polymerase I / U5 snRNP / U2 snRNA binding / spliceosomal snRNP assembly / U1 snRNA binding / Cajal body / regulation of DNA repair / U4/U6 x U5 tri-snRNP complex / catalytic step 2 spliceosome / mRNA Splicing - Major Pathway / Gene and protein expression by JAK-STAT signaling after Interleukin-12 stimulation / RNA splicing / stem cell differentiation / spliceosomal complex / double-strand break repair via homologous recombination / positive regulation of neuron projection development / mRNA splicing, via spliceosome / negative regulation of protein catabolic process / B-WICH complex positively regulates rRNA expression / nuclear matrix / fibrillar center / cytoplasmic ribonucleoprotein granule / mRNA processing / intracellular protein localization / site of double-strand break / snRNP Assembly / spermatogenesis / regulation of apoptotic process / SARS-CoV-2 modulates host translation machinery / RNA helicase activity / nuclear speck / nuclear body / RNA helicase / chromatin remodeling / mRNA binding / positive regulation of DNA-templated transcription / protein-containing complex binding / nucleolus / enzyme binding / positive regulation of transcription by RNA polymerase II / ATP hydrolysis activity / DNA binding / RNA binding / extracellular exosome / zinc ion binding / nucleoplasm / ATP binding / nucleus / membrane / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | ||||||
 データ登録者 データ登録者 | Zhang, X. / Zhan, X. / Shi, Y. | ||||||
| 資金援助 |  中国, 1件 中国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Mechanisms of the RNA helicases DDX42 and DDX46 in human U2 snRNP assembly. 著者: Fenghua Yang / Tong Bian / Xiechao Zhan / Zhe Chen / Zhihan Xing / Nicolas A Larsen / Xiaofeng Zhang / Yigong Shi /   要旨: Three RNA helicases - DDX42, DDX46 and DHX15 - are found to be associated with human U2 snRNP, but their roles and mechanisms in U2 snRNP and spliceosome assembly are insufficiently understood. Here ...Three RNA helicases - DDX42, DDX46 and DHX15 - are found to be associated with human U2 snRNP, but their roles and mechanisms in U2 snRNP and spliceosome assembly are insufficiently understood. Here we report the cryo-electron microscopy (cryo-EM) structures of the DDX42-SF3b complex and a putative assembly precursor of 17S U2 snRNP that contains DDX42 (DDX42-U2 complex). DDX42 is anchored on SF3B1 through N-terminal sequences, with its N-plug occupying the RNA path of SF3B1. The binding mode of DDX42 to SF3B1 is in striking analogy to that of DDX46. In the DDX42-U2 complex, the N-terminus of DDX42 remains anchored on SF3B1, but the helicase domain has been displaced by U2 snRNA and TAT-SF1. Through in vitro assays, we show DDX42 and DDX46 are mutually exclusive in terms of binding to SF3b. Cancer-driving mutations of SF3B1 target the residues in the RNA path that directly interact with DDX42 and DDX46. These findings reveal the distinct roles of DDX42 and DDX46 in assembly of 17S U2 snRNP and provide insights into the mechanisms of SF3B1 cancer mutations. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8hk1.cif.gz 8hk1.cif.gz | 852.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8hk1.ent.gz pdb8hk1.ent.gz | 587.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8hk1.json.gz 8hk1.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8hk1_validation.pdf.gz 8hk1_validation.pdf.gz | 1.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8hk1_full_validation.pdf.gz 8hk1_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  8hk1_validation.xml.gz 8hk1_validation.xml.gz | 111.7 KB | 表示 | |
| CIF形式データ |  8hk1_validation.cif.gz 8hk1_validation.cif.gz | 179.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/hk/8hk1 https://data.pdbj.org/pub/pdb/validation_reports/hk/8hk1 ftp://data.pdbj.org/pub/pdb/validation_reports/hk/8hk1 ftp://data.pdbj.org/pub/pdb/validation_reports/hk/8hk1 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  34841MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-RNA鎖 , 1種, 1分子 H
| #1: RNA鎖 | 分子量: 60186.445 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: GenBank: 340097 Homo sapiens (ヒト) / 参照: GenBank: 340097 |
|---|
-Splicing factor 3B subunit ... , 5種, 5分子 12345
| #2: タンパク質 | 分子量: 146024.938 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: O75533 Homo sapiens (ヒト) / 参照: UniProt: O75533 |
|---|---|
| #3: タンパク質 | 分子量: 100377.812 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q13435 Homo sapiens (ヒト) / 参照: UniProt: Q13435 |
| #4: タンパク質 | 分子量: 135718.844 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q15393 Homo sapiens (ヒト) / 参照: UniProt: Q15393 |
| #5: タンパク質 | 分子量: 44436.570 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q15427 Homo sapiens (ヒト) / 参照: UniProt: Q15427 |
| #6: タンパク質 | 分子量: 10149.369 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q9BWJ5 Homo sapiens (ヒト) / 参照: UniProt: Q9BWJ5 |
-タンパク質 , 4種, 4分子 6DEf
| #7: タンパク質 | 分子量: 12427.524 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q7RTV0 Homo sapiens (ヒト) / 参照: UniProt: Q7RTV0 |
|---|---|
| #11: タンパク質 | 分子量: 85965.961 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: O43719 Homo sapiens (ヒト) / 参照: UniProt: O43719 |
| #12: タンパク質 | 分子量: 103129.477 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q86XP3, RNA helicase Homo sapiens (ヒト) / 参照: UniProt: Q86XP3, RNA helicase |
| #20: タンパク質 | 分子量: 24642.131 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P14678 Homo sapiens (ヒト) / 参照: UniProt: P14678 |
-Splicing factor 3A subunit ... , 3種, 3分子 ABC
| #8: タンパク質 | 分子量: 88991.094 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q15459 Homo sapiens (ヒト) / 参照: UniProt: Q15459 |
|---|---|
| #9: タンパク質 | 分子量: 49327.355 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q15428 Homo sapiens (ヒト) / 参照: UniProt: Q15428 |
| #10: タンパク質 | 分子量: 58934.844 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q12874 Homo sapiens (ヒト) / 参照: UniProt: Q12874 |
-U2 small nuclear ribonucleoprotein ... , 2種, 2分子 FG
| #13: タンパク質 | 分子量: 28456.584 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P09661 Homo sapiens (ヒト) / 参照: UniProt: P09661 |
|---|---|
| #14: タンパク質 | 分子量: 25524.367 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P08579 Homo sapiens (ヒト) / 参照: UniProt: P08579 |
-Small nuclear ribonucleoprotein ... , 6種, 6分子 abcdeg
| #15: タンパク質 | 分子量: 13551.928 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P62316 Homo sapiens (ヒト) / 参照: UniProt: P62316 |
|---|---|
| #16: タンパク質 | 分子量: 9734.171 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P62306 Homo sapiens (ヒト) / 参照: UniProt: P62306 |
| #17: タンパク質 | 分子量: 10817.601 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P62304 Homo sapiens (ヒト) / 参照: UniProt: P62304 |
| #18: タンパク質 | 分子量: 8508.084 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P62308 Homo sapiens (ヒト) / 参照: UniProt: P62308 |
| #19: タンパク質 | 分子量: 13940.308 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P62318 Homo sapiens (ヒト) / 参照: UniProt: P62318 |
| #21: タンパク質 | 分子量: 13310.653 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P62314 Homo sapiens (ヒト) / 参照: UniProt: P62314 |
-非ポリマー , 2種, 5分子 


| #22: 化合物 | ChemComp-9B0 / [( |
|---|---|
| #23: 化合物 | ChemComp-ZN / |
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: The human pre-17S U2 snRNP / タイプ: COMPLEX / Entity ID: #1-#21 / 由来: NATURAL |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 7.9 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| CTF補正 | タイプ: NONE |
|---|---|
| 3次元再構成 | 解像度: 2.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 430443 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー







 PDBj
PDBj