[English] 日本語
 Yorodumi
Yorodumi- PDB-8bjh: chimera of the inactive ExoY Nucleotidyl Cyclase domain from Vibr... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 8bjh | ||||||
|---|---|---|---|---|---|---|---|
| Title | chimera of the inactive ExoY Nucleotidyl Cyclase domain from Vibrio nigripulchritudo MARTX toxin, with the double mutation K3528M and K3535I, fused to a proline-Rich-Domain (PRD) and profilin, bound to Latrunculin B-ADP-Mg-actin | ||||||
 Components Components |
| ||||||
 Keywords Keywords | TOXIN / bacterial nucleotidyl cyclase toxin / activated complex | ||||||
| Function / homology |  Function and homology information Function and homology informationcalcium- and calmodulin-responsive adenylate cyclase activity / synapse maturation / adenyl-nucleotide exchange factor activity / modification of postsynaptic actin cytoskeleton / negative regulation of actin filament bundle assembly / negative regulation of actin filament polymerization / positive regulation of actin filament bundle assembly / adenylate cyclase / regulation of actin filament polymerization / Signaling by ROBO receptors ...calcium- and calmodulin-responsive adenylate cyclase activity / synapse maturation / adenyl-nucleotide exchange factor activity / modification of postsynaptic actin cytoskeleton / negative regulation of actin filament bundle assembly / negative regulation of actin filament polymerization / positive regulation of actin filament bundle assembly / adenylate cyclase / regulation of actin filament polymerization / Signaling by ROBO receptors / positive regulation of ATP-dependent activity / proline-rich region binding / PCP/CE pathway / positive regulation of ruffle assembly / negative regulation of stress fiber assembly / cytoskeletal motor activator activity / host cell cytosol / myosin heavy chain binding / tropomyosin binding / actin filament bundle / troponin I binding / filamentous actin / mesenchyme migration / positive regulation of actin filament polymerization / skeletal muscle myofibril / actin filament bundle assembly / striated muscle thin filament / skeletal muscle thin filament assembly / positive regulation of epithelial cell migration / actin monomer binding / skeletal muscle fiber development / stress fiber / titin binding / phosphotyrosine residue binding / phosphatidylinositol-4,5-bisphosphate binding / actin filament polymerization / actin filament / filopodium / neural tube closure / RHO GTPases Activate Formins / modulation of chemical synaptic transmission / small GTPase binding / Hydrolases; Acting on acid anhydrides; Acting on acid anhydrides to facilitate cellular and subcellular movement / calcium-dependent protein binding / Platelet degranulation / lamellipodium / transferase activity / toxin activity / actin binding / cell body / actin cytoskeleton organization / cell cortex / blood microparticle / cytoskeleton / protein stabilization / hydrolase activity / cadherin binding / protein domain specific binding / focal adhesion / cysteine-type endopeptidase activity / calcium ion binding / positive regulation of gene expression / regulation of transcription by RNA polymerase II / host cell plasma membrane / glutamatergic synapse / magnesium ion binding / proteolysis / RNA binding / extracellular exosome / extracellular region / ATP binding / metal ion binding / identical protein binding / nucleus / membrane / cytosol / cytoplasm Similarity search - Function | ||||||
| Biological species |  Vibrio nigripulchritudo (bacteria) Vibrio nigripulchritudo (bacteria) Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.69 Å MOLECULAR REPLACEMENT / Resolution: 1.69 Å | ||||||
 Authors Authors | Teixeira-Nunes, M. / Renault, L. / Retailleau, P. | ||||||
| Funding support |  France, 1items France, 1items
| ||||||
 Citation Citation |  Journal: Plos Pathog. / Year: 2023 Journal: Plos Pathog. / Year: 2023Title: Functional and structural insights into the multi-step activation and catalytic mechanism of bacterial ExoY nucleotidyl cyclase toxins bound to actin-profilin. Authors: Teixeira-Nunes, M. / Retailleau, P. / Raoux-Barbot, D. / Comisso, M. / Missinou, A.A. / Velours, C. / Plancqueel, S. / Ladant, D. / Mechold, U. / Renault, L. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  8bjh.cif.gz 8bjh.cif.gz | 379.3 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb8bjh.ent.gz pdb8bjh.ent.gz | 300.3 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  8bjh.json.gz 8bjh.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  8bjh_validation.pdf.gz 8bjh_validation.pdf.gz | 1.6 MB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  8bjh_full_validation.pdf.gz 8bjh_full_validation.pdf.gz | 1.7 MB | Display | |
| Data in XML |  8bjh_validation.xml.gz 8bjh_validation.xml.gz | 42.1 KB | Display | |
| Data in CIF |  8bjh_validation.cif.gz 8bjh_validation.cif.gz | 65.5 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/bj/8bjh https://data.pdbj.org/pub/pdb/validation_reports/bj/8bjh ftp://data.pdbj.org/pub/pdb/validation_reports/bj/8bjh ftp://data.pdbj.org/pub/pdb/validation_reports/bj/8bjh | HTTPS FTP |
-Related structure data
| Related structure data |  8bjiC  8bjjC  8bo1C  8br0C  8br1C  2pavS  7pj0  7pqj  7psb S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 2 types, 2 molecules AB
| #1: Protein | Mass: 41862.613 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
|---|---|
| #2: Protein | Mass: 65218.859 Da / Num. of mol.: 1 / Mutation: K528M K535I Source method: isolated from a genetically manipulated source Details: chimera containing ExoY nucleotidyl cyclase domain from Vibrio nigripulchritudo MARTX (amino-acids 4 to 446), fused to a Proline-Rich-Motif (amino-acids 447 to 450) and human profilin 1 ...Details: chimera containing ExoY nucleotidyl cyclase domain from Vibrio nigripulchritudo MARTX (amino-acids 4 to 446), fused to a Proline-Rich-Motif (amino-acids 447 to 450) and human profilin 1 (amino-acids 453 to 591, Uniprot: P07737) Source: (gene. exp.)  Vibrio nigripulchritudo (bacteria), (gene. exp.) Vibrio nigripulchritudo (bacteria), (gene. exp.)  Homo sapiens (human) Homo sapiens (human)Gene: VIBNISFn135_p10220, PFN1 / Cell (production host): BL21(DE3) / Production host:  References: UniProt: A0A6N3LUE9, UniProt: P07737, adenylate cyclase |
-Non-polymers , 9 types, 977 molecules 




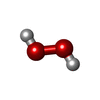











| #3: Chemical | ChemComp-ADP / | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| #4: Chemical | ChemComp-MG / | ||||||||||
| #5: Chemical | ChemComp-LAB / | ||||||||||
| #6: Chemical | | #7: Chemical | #8: Chemical | ChemComp-PEO / #9: Chemical | #10: Chemical | ChemComp-PEG / | #11: Water | ChemComp-HOH / | |
-Details
| Has ligand of interest | Y |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.24 Å3/Da / Density % sol: 45.18 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, hanging drop / pH: 8.5 Details: 30% PEG4000 0.2M LISO4 0.1M TRIS PH8.5, VAPOR DIFFUSION, HANGING DROP, TEMPERATURE 293K |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SOLEIL SOLEIL  / Beamline: PROXIMA 1 / Wavelength: 0.9793 Å / Beamline: PROXIMA 1 / Wavelength: 0.9793 Å |
| Detector | Type: DECTRIS EIGER X 16M / Detector: PIXEL / Date: Jun 12, 2020 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.9793 Å / Relative weight: 1 |
| Reflection | Resolution: 1.69→93.57 Å / Num. obs: 81375 / % possible obs: 94.9 % / Redundancy: 6.9 % / Biso Wilson estimate: 30.1 Å2 / Rmerge(I) obs: 0.081 / Net I/σ(I): 11.2 |
| Reflection shell | Resolution: 1.69→1.85 Å / Redundancy: 6.4 % / Rmerge(I) obs: 0.91 / Mean I/σ(I) obs: 1.7 / Num. unique obs: 1539 / % possible all: 60.1 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 2PAV Resolution: 1.69→93.57 Å / Cor.coef. Fo:Fc: 0.958 / Cor.coef. Fo:Fc free: 0.945 / SU R Cruickshank DPI: 0.132 / Cross valid method: THROUGHOUT / σ(F): 0 / SU R Blow DPI: 0.142 / SU Rfree Blow DPI: 0.127 / SU Rfree Cruickshank DPI: 0.122
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 101.12 Å2 / Biso mean: 34.97 Å2 / Biso min: 14.82 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.22 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 1.69→93.57 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.69→1.8 Å / Rfactor Rfree error: 0 / Total num. of bins used: 51
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller


 PDBj
PDBj


















