+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 7x5e | ||||||
|---|---|---|---|---|---|---|---|
| Title | Nrf2-MafG heterodimer bound with CsMBE1 | ||||||
 Components Components |
| ||||||
 Keywords Keywords | TRANSCRIPTION/DNA / Transcription factor / CNC-bZIP / Stress response / TRANSCRIPTION / TRANSCRIPTION-DNA complex | ||||||
| Function / homology |  Function and homology information Function and homology informationpositive regulation of glutathione biosynthetic process / aflatoxin catabolic process / negative regulation of hematopoietic stem cell differentiation / integrated stress response signaling / Regulation of HMOX1 expression and activity / negative regulation of cellular response to hypoxia / NFE2L2 regulating TCA cycle genes / positive regulation of ERAD pathway / PERK-mediated unfolded protein response / regulation of removal of superoxide radicals ...positive regulation of glutathione biosynthetic process / aflatoxin catabolic process / negative regulation of hematopoietic stem cell differentiation / integrated stress response signaling / Regulation of HMOX1 expression and activity / negative regulation of cellular response to hypoxia / NFE2L2 regulating TCA cycle genes / positive regulation of ERAD pathway / PERK-mediated unfolded protein response / regulation of removal of superoxide radicals / regulation of cellular response to oxidative stress / cellular response to laminar fluid shear stress / regulation of epidermal cell differentiation / NFE2L2 regulating ER-stress associated genes / NFE2L2 regulating inflammation associated genes / cellular response to methionine / mediator complex / cellular response to fluid shear stress / NFE2L2 regulates pentose phosphate pathway genes / NFE2L2 regulating MDR associated enzymes / positive regulation of ubiquitin-dependent protein catabolic process / Regulation of NFE2L2 gene expression / Nuclear events mediated by NFE2L2 / negative regulation of cardiac muscle cell apoptotic process / NFE2L2 regulating tumorigenic genes / NFE2L2 regulating anti-oxidant/detoxification enzymes / proteasomal ubiquitin-independent protein catabolic process / negative regulation of ferroptosis / regulation of innate immune response / negative regulation of vascular associated smooth muscle cell migration / adult behavior / cellular response to angiotensin / regulation of embryonic development / positive regulation of blood vessel endothelial cell migration / positive regulation of blood coagulation / negative regulation of endothelial cell apoptotic process / negative regulation of oxidative stress-induced intrinsic apoptotic signaling pathway / endoplasmic reticulum unfolded protein response / cellular response to glucose starvation / reactive oxygen species metabolic process / cell redox homeostasis / cellular response to copper ion / response to ischemia / transcription coregulator binding / positive regulation of D-glucose import across plasma membrane / molecular condensate scaffold activity / Heme signaling / GSK3B and BTRC:CUL1-mediated-degradation of NFE2L2 / positive regulation of neuron projection development / protein-DNA complex / RNA polymerase II transcription regulator complex / cellular response to xenobiotic stimulus / positive regulation of reactive oxygen species metabolic process / cellular response to hydrogen peroxide / positive regulation of angiogenesis / sequence-specific double-stranded DNA binding / cellular response to tumor necrosis factor / KEAP1-NFE2L2 pathway / regulation of cell population proliferation / Factors involved in megakaryocyte development and platelet production / Neddylation / response to oxidative stress / DNA-binding transcription activator activity, RNA polymerase II-specific / cellular response to oxidative stress / cellular response to hypoxia / sequence-specific DNA binding / in utero embryonic development / Potential therapeutics for SARS / proteasome-mediated ubiquitin-dependent protein catabolic process / RNA polymerase II-specific DNA-binding transcription factor binding / DNA-binding transcription factor activity, RNA polymerase II-specific / transcription cis-regulatory region binding / ciliary basal body / protein ubiquitination / RNA polymerase II cis-regulatory region sequence-specific DNA binding / DNA-binding transcription factor activity / inflammatory response / protein domain specific binding / ubiquitin protein ligase binding / positive regulation of gene expression / centrosome / regulation of transcription by RNA polymerase II / positive regulation of DNA-templated transcription / chromatin / negative regulation of transcription by RNA polymerase II / Golgi apparatus / positive regulation of transcription by RNA polymerase II / DNA binding / nucleoplasm / identical protein binding / nucleus / plasma membrane / cytoplasm / cytosol Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human)synthetic construct (others) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.3 Å MOLECULAR REPLACEMENT / Resolution: 2.3 Å | ||||||
 Authors Authors | Sengoku, T. / Shiina, M. / Suzuki, K. / Hamada, K. / Sato, K. / Uchiyama, A. / Okada, C. / Baba, S. / Ohta, T. / Motohashi, H. ...Sengoku, T. / Shiina, M. / Suzuki, K. / Hamada, K. / Sato, K. / Uchiyama, A. / Okada, C. / Baba, S. / Ohta, T. / Motohashi, H. / Yamamoto, M. / Ogata, K. | ||||||
| Funding support |  Japan, 1items Japan, 1items
| ||||||
 Citation Citation |  Journal: Nucleic Acids Res. / Year: 2022 Journal: Nucleic Acids Res. / Year: 2022Title: Structural basis of transcription regulation by CNC family transcription factor, Nrf2. Authors: Sengoku, T. / Shiina, M. / Suzuki, K. / Hamada, K. / Sato, K. / Uchiyama, A. / Kobayashi, S. / Oguni, A. / Itaya, H. / Kasahara, K. / Moriwaki, H. / Watanabe, C. / Honma, T. / Okada, C. / ...Authors: Sengoku, T. / Shiina, M. / Suzuki, K. / Hamada, K. / Sato, K. / Uchiyama, A. / Kobayashi, S. / Oguni, A. / Itaya, H. / Kasahara, K. / Moriwaki, H. / Watanabe, C. / Honma, T. / Okada, C. / Baba, S. / Ohta, T. / Motohashi, H. / Yamamoto, M. / Ogata, K. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  7x5e.cif.gz 7x5e.cif.gz | 305.3 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb7x5e.ent.gz pdb7x5e.ent.gz | 201.4 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  7x5e.json.gz 7x5e.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/x5/7x5e https://data.pdbj.org/pub/pdb/validation_reports/x5/7x5e ftp://data.pdbj.org/pub/pdb/validation_reports/x5/7x5e ftp://data.pdbj.org/pub/pdb/validation_reports/x5/7x5e | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  7x5fC  7x5gC  3a5tS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||
| 2 | 
| ||||||||||
| Unit cell |
|
- Components
Components
-Protein , 2 types, 4 molecules AEBF
| #1: Protein | Mass: 12071.857 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: MAFG / Production host: Homo sapiens (human) / Gene: MAFG / Production host:  #2: Protein | Mass: 13255.474 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: NRF2 / Production host: Homo sapiens (human) / Gene: NRF2 / Production host:  |
|---|
-DNA chain , 2 types, 4 molecules CGDH
| #3: DNA chain | Mass: 4864.164 Da / Num. of mol.: 2 / Source method: obtained synthetically / Source: (synth.) synthetic construct (others) #4: DNA chain | Mass: 4931.230 Da / Num. of mol.: 2 / Source method: obtained synthetically / Source: (synth.) synthetic construct (others) |
|---|
-Non-polymers , 2 types, 169 molecules 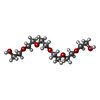


| #5: Chemical | ChemComp-P6G / |
|---|---|
| #6: Water | ChemComp-HOH / |
-Details
| Has ligand of interest | N |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 4.11 Å3/Da / Density % sol: 70.05 % |
|---|---|
| Crystal grow | Temperature: 298 K / Method: vapor diffusion Details: 50 mM MES monohydrate (pH 5.6), 20 mM KCl, 10 mM MgSO4 heptahydrate, 7%(v/v) PEG400 |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Photon Factory Photon Factory  / Beamline: BL-17A / Wavelength: 1 Å / Beamline: BL-17A / Wavelength: 1 Å |
| Detector | Type: ADSC QUANTUM 315 / Detector: CCD / Date: Jan 31, 2011 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1 Å / Relative weight: 1 |
| Reflection | Resolution: 2.3→50 Å / Num. obs: 50732 / % possible obs: 99.2 % / Redundancy: 3.1 % / Biso Wilson estimate: 43.4 Å2 / Rsym value: 0.075 / Net I/σ(I): 12.2 |
| Reflection shell | Resolution: 2.3→2.38 Å / Redundancy: 3.1 % / Rmerge(I) obs: 0.43 / Mean I/σ(I) obs: 2.5 / Num. unique obs: 5033 / % possible all: 99.8 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 3A5T Resolution: 2.3→40.85 Å / SU ML: 0.3155 / Cross valid method: FREE R-VALUE / σ(F): 1.35 / Phase error: 27.3127 Stereochemistry target values: GeoStd + Monomer Library + CDL v1.2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 58.35 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.3→40.85 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group | Refine-ID: X-RAY DIFFRACTION
|
 Movie
Movie Controller
Controller



 PDBj
PDBj







































