+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7vh5 | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
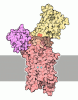
| タイトル | Cryo-EM structure of the hexameric plasma membrane H+-ATPase in the autoinhibited state (pH 7.4, C1 symmetry) | |||||||||||||||||||||||||||
 要素 要素 | Plasma membrane ATPase 1 | |||||||||||||||||||||||||||
 キーワード キーワード | TRANSLOCASE / P type ATPase / plasma membrane H+-ATPase / hexamer | |||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報P-type H+-exporting transporter / eisosome / proton export across plasma membrane / proteasome storage granule assembly / P-type proton-exporting transporter activity / positive regulation of TORC1 signaling / proton transmembrane transport / regulation of intracellular pH / transmembrane transport / membrane raft ...P-type H+-exporting transporter / eisosome / proton export across plasma membrane / proteasome storage granule assembly / P-type proton-exporting transporter activity / positive regulation of TORC1 signaling / proton transmembrane transport / regulation of intracellular pH / transmembrane transport / membrane raft / ATP hydrolysis activity / mitochondrion / ATP binding / metal ion binding / plasma membrane / cytosol 類似検索 - 分子機能 | |||||||||||||||||||||||||||
| 生物種 |  | |||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||||||||||||||||||||
 データ登録者 データ登録者 | Zhao, P. / Zhao, C. / Chen, D. / Yun, C. / Li, H. / Bai, L. | |||||||||||||||||||||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Structure and activation mechanism of the hexameric plasma membrane H-ATPase. 著者: Peng Zhao / Chaoran Zhao / Dandan Chen / Caihong Yun / Huilin Li / Lin Bai /   要旨: The S. cerevisiae plasma membrane H-ATPase, Pma1, is a P3A-type ATPase and the primary protein component of the membrane compartment of Pma1 (MCP). Like other plasma membrane H-ATPases, Pma1 ...The S. cerevisiae plasma membrane H-ATPase, Pma1, is a P3A-type ATPase and the primary protein component of the membrane compartment of Pma1 (MCP). Like other plasma membrane H-ATPases, Pma1 assembles and functions as a hexamer, a property unique to this subfamily among the larger family of P-type ATPases. It has been unclear how Pma1 organizes the yeast membrane into MCP microdomains, or why it is that Pma1 needs to assemble into a hexamer to establish the membrane electrochemical proton gradient. Here we report a high-resolution cryo-EM study of native Pma1 hexamers embedded in endogenous lipids. Remarkably, we found that the Pma1 hexamer encircles a liquid-crystalline membrane domain composed of 57 ordered lipid molecules. The Pma1-encircled lipid patch structure likely serves as the building block of the MCP. At pH 7.4, the carboxyl-terminal regulatory α-helix binds to the phosphorylation domains of two neighboring Pma1 subunits, locking the hexamer in the autoinhibited state. The regulatory helix becomes disordered at lower pH, leading to activation of the Pma1 hexamer. The activation process is accompanied by a 6.7 Å downward shift and a 40° rotation of transmembrane helices 1 and 2 that line the proton translocation path. The conformational changes have enabled us to propose a detailed mechanism for ATP-hydrolysis-driven proton pumping across the plasma membrane. Our structures will facilitate the development of antifungal drugs that target this essential protein. | |||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7vh5.cif.gz 7vh5.cif.gz | 854 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7vh5.ent.gz pdb7vh5.ent.gz | 724.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7vh5.json.gz 7vh5.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7vh5_validation.pdf.gz 7vh5_validation.pdf.gz | 1.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7vh5_full_validation.pdf.gz 7vh5_full_validation.pdf.gz | 1.9 MB | 表示 | |
| XML形式データ |  7vh5_validation.xml.gz 7vh5_validation.xml.gz | 157.4 KB | 表示 | |
| CIF形式データ |  7vh5_validation.cif.gz 7vh5_validation.cif.gz | 218.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/vh/7vh5 https://data.pdbj.org/pub/pdb/validation_reports/vh/7vh5 ftp://data.pdbj.org/pub/pdb/validation_reports/vh/7vh5 ftp://data.pdbj.org/pub/pdb/validation_reports/vh/7vh5 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 99714.023 Da / 分子数: 6 / 由来タイプ: 組換発現 由来: (組換発現)  株: ATCC 204508 / S288c / 遺伝子: PMA1, YGL008C / 発現宿主:  #2: 化合物 | ChemComp-POV / ( #3: 化合物 | ChemComp-SPH / | 研究の焦点であるリガンドがあるか | N | Has protein modification | N | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Plasma membrane ATPase 1 / タイプ: COMPLEX / Entity ID: #1 / 由来: NATURAL |
|---|---|
| 分子量 | 値: 99.6 kDa/nm / 実験値: YES |
| 由来(天然) | 生物種:  |
| 緩衝液 | pH: 7.4 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R2/1 |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 撮影 | 電子線照射量: 1.6 e/Å2 フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.18.2_3874: / 分類: 精密化 |
|---|---|
| EMソフトウェア | 名称: PHENIX / カテゴリ: モデル精密化 |
| CTF補正 | タイプ: NONE |
| 3次元再構成 | 解像度: 3.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 179392 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj